新闻中心
联系方式
华道纵横(深圳)技术有限公司
全国服务热线:4006-010-725
深圳:南山区粤海街道环东路西环北路北滨海之窗花园
客服QQ:574472821
微 信:13077829315
手 机:130-7782-9315
邮 箱:shbsfw#126.com
网址:www.gdhdgw.com
新闻动态
《保健食品卫生学理化检验规范(征求意见稿)》全文
添加时间:2019-6-14 录入:深圳华道顾问 来源:深圳华道顾问

目 录
第一部分
General Principles
一、主题内容和适用范围
Content and Scope of Application
1.本规范规定了保健食品和原料的卫生学技术要求的检验项目及方法。
2.本规范适用于保健食品的注册、复核和备案检验、监督抽验、风险监测及常规检验项目的确定和方法的选择。
二、基本要求
Basic Requirements
1. 凡保健食品,应符合GB 16740《食品安全国家标准 保健食品》的各项要求。附表1所列检测项目是对该标准的补充规定。
2. 保健食品中食品添加剂的使用应符合GB 2760的规定和(或)有关规定。检测机构可根据实际需要,按产品配方检测合成色素、防腐剂、甜味剂及抗氧化剂的含量。
3. 保健食品的包装材料应符合GB 4806.1《食品安全国家标准 食品接触材料及制品通用安全要求》的要求。
4. 进行辐照灭菌的产品,其辐照源、辐照剂量等均应符合相应的国家标准、行业标准或有关要求。
5. 检验机构受理保健食品检测时,申报单位应提供该产品的配方、工艺、产品技术要求及功效成分/标志性成分检测方法研究验证等相关资料。
6. 申请单位在对产品进行功效成分/标志性成分检测时,如国家标准中所提供的检测方法不适用于该产品检验时,可优先选择本规范第二部分提供的检测方法,并进行必要的方法学适用性研究;如规范中所提供的检测方法不适用于该产品检验时,申请单位可选择行业标准、国际上权威分析方法进行测定,并进行必要的方法适用性研究。注册检验机构对所附材料进行审核,必要时进行有关验证和方法确认,如申报单位提供的方法不适合送检的样品时,注册检验机构不得擅自修改,应将有关情况反馈申报单位,由其进行研究并提供方法后,再对送检样品进行试验,确保试验方法与送检产品技术要求中规定的方法一致。复核检验机构应按照申报单位提交的检验方法进行检验并出具复核检验报告。
7. 保健食品中原料和辅料应符合《保健食品注册与备案管理办法》中原、辅料质量要求的规定,并符合相应的食品国家标准。原料若为植物提取物或者原料及辅料加工过程中使用、间接引入有机溶剂时,涉及的有机溶剂应符合GB 2760《食品安全国家标准 食品添加剂使用标准》附录C中食品工业用加工助剂使用名单规定,或其他相关标准的要求。企业可根据产品质量控制需要,采用本规范中第三部分保健食品中十一种溶剂残留的测定方法将溶剂残留检测列入原料及产品的技术要求。
8. 针对各类功效的保健食品,需参照本规范第四部分兴奋剂及违禁成分测定方法进行非法添加筛查。同时,需进行配方分析,如明确存在原料带入情况的指标,应检测相关项目,报出检测结果,但不作为非法添加结果报送,除结果异常外。
9. 不同剂型及特定原料类别产品的卫生学理化检验应包括本规范第五部分中规定的相应检测项目。
10. 保健食品应具有与产品配方和申报的保健功能相适应的功效成分或标志性成分,申报时须提供配方中主要原料所含的功效成分或标志性成分的检测结果、检方法及方法学验证结果。第六部分列出了原料类型及相应检测项目,以所列原料为主的产品须检测表中规定的项目。
11. 普通食品形态产品应检测并制定净含量及允许负偏差指标,需要按照产品质量标准规定规格的最小包装确定检测依据,指标应符合《定量包装商品净含量计量检验规则》(JJF 1070)规定;《中国药典》“制剂通则”项下有相应要求的产品剂型,应检测并制定装量差异或重量差异指标,指标应符合规定。装量或净含量只检测内容物,不包括隔离材料,如胶囊壳等。
12. 最小服用单元含有惰性隔离材料填充的产品,如胶囊,其功效成分或者指标成分、农药残留、水分、灰分等指标以去除隔离材料(胶囊壳)的内容物为检测单元,对于非法添加药物、重金属、铬、色素(如材料带颜色)等则需要进行整体检测,或者检测结果明确标识相关检测部位。
13. 标准规定不得检出的项目结果,方法定量限以上检测结果,按照具体检出值报送结果;方法检出限以下检测结果,注明“未检出,检出限值”;方法检出限以上、定量限以下检测结果,注明“检出且小于定量限,定量限值,检出限值”。
14. 注册检验机构应按照国家相关规定和标准等要求,根据样品具体情况,合理地进行稳定性试验设计和研究。通过稳定性试验,考察样品在不同环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学特征随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。产品稳定性重点考察指标,主要包括鉴别、感官、微生物、崩解时限(溶散时限、溶化性等)、水分、pH值、酸价、过氧化值、真菌毒素、列入理化指标中的功效成分/标志性成分等随储存条件和储存时间容易发生变化的指标。产品非稳定性重点考察指标,主要包括灰分、污染物(如铅、总砷、总汞等)、农残(如六六六、滴滴涕等)、国家相关标准及现行规定有用量限制的合成色素和甜味剂等随储存条件和贮存时间不易发生变化的指标,以及国家相关标准及现行规定有用量限制的抗氧化剂指标。
第二部分
检验方法
and Iconic Components
一、保健食品中红景天苷的测定
Determination of salidroside in health food
1 范围
本方法规定了以红景天为主要原料的保健食品中红景天苷的液相色谱测定方法。
本方法适用于保健品食品中红景天苷的测定,也适用于保健食品中酪醇的测定。
2 原理
试样经甲醇超声提取,以0.01 mol/L 乙酸铵-甲醇为流动相(80+20),采用高效液相色谱法,紫外检测器检测,根据保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 乙酸铵( CH3COONH4 )。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 甲醇(CH3OH)。
3.2 试剂配制
乙酸铵溶液 (0.01 mol/L):称取0.77 g乙酸铵,加入适量水溶解,用水定容至1000 mL,经0.45 μm水相微孔滤膜过滤后备用。
3.3 标准品
红景天苷(C14H20O7):纯度≥98%。
酪醇(C8H10O2):纯度≥98%。
3.4 标准溶液的配制
3.4.1 红景天苷标准储备液(2.0 mg/mL): 准确称取红景天苷标准品0.02 g于 10 mL 容量瓶中,用甲醇(3.1.2)溶解并定容至刻度 ,摇匀。
3.4.2 红景天苷标准工作液:将红景天苷标准储备液(3.4.1)用甲醇(3.1.2)稀释制备一系列标准溶液,标准系列浓度为0mg/mL、0.01 mg/mL、0.02 mg/mL、0.05mg/mL、0.20 mg/mL、0.50 mg/mL,临用时配制。
3.4.3 酪醇标准储备液(2.0 mg/mL):准确称取酪醇标准品0.02 g于 10 mL 容量瓶中,用甲醇(3.1.2)溶解并定容至刻度 ,摇匀。
3.4.4 系统适用性溶液:准确吸取红景天苷标准储备液(3.4.1)和酪醇标准储备液(3.4.3)各0.5mL于 10 mL 容量瓶中,用甲醇(3.1.2)稀释至刻度 ,摇匀。
4 仪器设备
4.1 高效液相色谱仪: 配有紫外检测器(UV)。
4.2 超声波清洗器。
4.3 分析天平:感量为0.01 mg,0.1 mg。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:取20粒以上片剂或胶囊试样进行粉碎、混匀,准确称取适量试样(约含红景天苷2.5mg)于 25 mL 容量瓶中,加入甲醇(3.1.3)约20mL,超声提取30 min,放冷至室温,用甲醇(3.1.3)定容至刻度。混匀后经0.45 μm滤膜过滤,供液相色谱分析用。
5.1.2 液体样品:准确吸取适量摇匀后的试样(约含红景天苷2.5mg)于25 mL容量瓶中,用甲醇(3.1.3)定容至刻度。混匀后经0.45 μm滤膜过滤,供液相色谱分析用。
5.2 色谱参考条件
5.2.1 色谱柱:C18柱,柱长250mm,内径4.6mm,填料粒径5 μm,或同等性能色谱柱;
5.2.2 流动相:乙酸铵溶液(0.01 mol/L)-甲醇(80+20);
5.2.3 流速:1.0 mL/min;
5.2.4 柱温:25 ℃;
5.2.5 检测波长:215 nm;
5.2.6 进样量:10 mL。
5.2.7 系统适用性试验:取系统适用性溶液(3.4.4)10 mL,注入液相色谱仪,记录色谱图,红景天苷峰与酪醇峰的分离度应大于1.5。
5.3 标准曲线的制作
将标准系列工作液(3.4.2)分别注入高效液相色谱仪中,测定相应的色谱峰高或峰面积,以标准工作液的浓度为横坐标,以峰面积或峰高为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图A.1)。
5.4 试样溶液的测定
将试样待测液(5.1.1或5.1.2)注入液相色谱仪中,以保留时间定性,测得峰面积或峰高,根据标准曲线得到待测液红景天苷的浓度(样品溶液液相色谱图见附录A中图A.2)。
6 分析结果的表述
试样中红景天苷含量按式(1)计算:
C ×V
X = × 100 .......................................(1)
m
式中:
X -试样中红景天苷的含量,单位为毫克每百克或毫克每百毫升(mg/100g或mg/100mL);
C—由标准曲线查得待测样液中红景天苷的浓度,单位为毫克每毫升(mg/mL);
V—样品的定容体积,单位为毫升(mL);
m—样品量,单位为克或毫升(g或mL);
100—单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
当称样量为 1 g,定容体积为 25 mL时,红景天苷的检出限为50m g/g。
附录 A
标准溶液和试样溶液典型液相色谱图
A.1 红景天苷和酪醇标准溶液色谱图,见图 A.1。
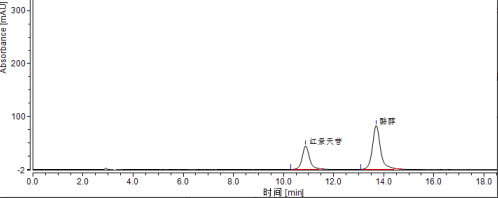
图 A.1 红景天苷和酪醇标准溶液(0.1mg/mL)色谱图
A.2 含有红景天苷和酪醇的试样溶液色谱图,见图 A.2。
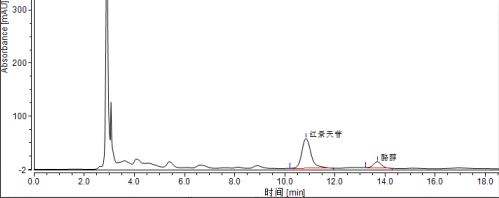
图 A.2 含有红景天苷和酪醇的试样溶液色谱图
二、保健食品中大蒜素的测定
Determination of allicin in health food
1 范围
本方法规定了保健食品中大蒜素的测定方法。
本方法适用于以大蒜及其加工品为主要原料制成的保健食品中大蒜素的测定。
2 原理
试样经有机溶剂提取,通过气相色谱检测,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯。
3.1 试剂
3.1.1 无水乙醇(C2H5OH)。
3.1.2 正己烷(CH3(CH2)4CH3)。
3.1.3 无水硫酸钠(Na2SO4)。
3.2 标准品
大蒜素(C6H10S3):纯度≥99.0%。
3.3 标准溶液配制
3.3.1大蒜素标准储备液(10.0mg/mL):称取100.0mg大蒜素标准物质于10mL 容量瓶中,用正己烷定容至刻度,摇匀。此溶液可在冰箱中保存七天。
3.3.2大蒜素标准工作液(1.0mg/mL):吸取大蒜素标准储备液 1.0mL于 10mL容量瓶中,用正己烷定容至刻度,摇匀,得浓度为1.0mg/mL的标准工作液,临用时配制。
4 仪器
4.1 气相色谱仪:配有氢火焰离子化检测器( FID)。
4.2 天平:感量为 0.1 mg 和 0.01 mg。
4.3 超声清洗器。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
称取已粉碎混合均匀的固体待测试样适量(含待测组分约5mg,精确到 0.0001 g)于5mL容量瓶中,加无水乙醇2.5mL,密塞,超声20min,取出冷却至室温,加正己烷定容,摇匀,过0.45μm微孔滤膜过滤,待上机测试用。
5.1.2 油状试样
称取已混合均匀的油状待测试样适量(含待测组分约5mg,精确到 0.0001 g)于5mL容量瓶中,加正己烷溶解并定容,摇匀,待上机测试用。
5.1.3 含水液体试样
精密吸取已混合均匀的待测试样适量(含待测组分约10mg),置于分液漏斗中,加5mL正己烷振摇提取1min,静置分层,取上层清液过无水硫酸钠,提取两次。用适量正己烷冲洗无水硫酸钠,合并至同一10mL容量瓶中,正己烷定容,摇匀。待上机测试用。
5.2 色谱参考条件
5.2.1 色谱柱:(5%-苯基)-甲基聚硅氧烷固定相,柱长30m,内径0.25mm,膜厚0.25μm或其他同等性能色谱柱。
5.2.2柱温箱温度: 起始温度100℃保持3分钟, 10℃/min速度升至150℃,再以20℃/min速度升至200℃,保持20min。
5.2.3 进样口温度:220℃;进样量1 μL。
5.2.4 检测器温度:250℃。
5.2.5 载气:高纯氮气,流量1.0mL/min。
5.2.6 氢气:40mL/min ;空气:400mL/min。
5.3 测定
将 1 μL 的标准溶液(3.3.2)和试样待测液(5. 1)注入气相色谱仪中,以保留时间定性,测得峰面积或峰高,外标峰面积或峰高法定量。(标准溶液图谱及试样图谱见附录A)
6 分析结果的表述
试样中大蒜素含量按式(1)计算
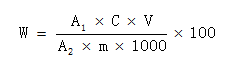 ..........................................(1)
..........................................(1)式中:
W—大蒜素的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
A1—试样使用液色谱峰面积或峰高;
A2—标准使用液峰面积或峰高;
C—标准使用液浓度,单位为毫克每毫升( mg/mL);
V—试样定容体积,单位为毫升( mL);
m—试样的质量或体积,单位为克或毫升( g或mL);
100—单位转换;
1000—单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
当固体试样和油状试样称样量为0.1g,定容体积为5.0mL时,大蒜素的检出限为0.20g/100g。当液体取样量为0.2mL,定容体积为10mL时,大蒜素的检出限为0.22g/100mL。
附录A
标准溶液和试样溶液典型气相色谱图
A.1大蒜素标准溶液色谱图,见图A.1。
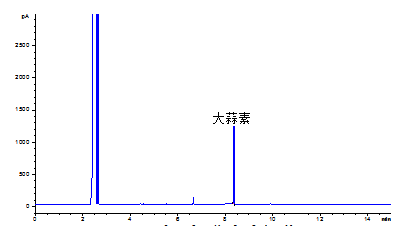
图A.1大蒜素标准溶液色谱图
A.2含有大蒜素的试样溶液色谱图,见图A.2。

图A.2含有大蒜素的试样溶液色谱图
三、保健食品中芦荟苷的测定
Determination of aloin in health food
1 范围
本标准规定了保健食品中芦荟苷的液相色谱测定方法。
本标准适用于以芦荟及其加工品为原料的保健食品中芦荟苷含量的测定。
2 原理
样品用甲醇+水(55+45)作为溶剂,提取试样中的芦荟苷,经液相色谱仪C18 柱分离,在293 nm波长处检测,以芦荟苷保留时间定性,峰面积定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 石油醚:沸程30℃~60℃。
3.2 标准品
芦荟苷标准品(C21H22O9)。
3.3 标准溶液的配制
3.3.1 芦荟苷标准储备溶液:称取10.00 mg芦荟苷标准品于25 mL 容量瓶中,加流动相溶解并定容至刻度,摇匀。
3.3.2 芦荟苷标准工作液:分别吸取芦荟苷标准储备溶液0.5 mL、1.0 mL、2.0 mL、4.0 mL、6.0 mL至10 mL容量瓶中,用流动相定容,得浓度为20 μg/mL、40 μg/mL、80 μg/mL、160 μg/mL、240 μg/mL的标准工作液。
4 仪器设备
4.1 高效液相色谱仪:配紫外检测器或二极管阵列检测器。
4.2 超声波清洗器。
4.3 分析天平:感量1 mg,0.1 mg。
4.4 离心机:转速≥3000 r/min。
4.5 微孔滤膜:0.45 μm。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
称取已粉碎混合均匀的待测试样1 g(精确到 0.001 g),置具塞锥形瓶中,加入50.0 mL流动相,称重,超声处理10 min,放冷,用流动相补足减失的重量,摇匀,经0.45 μm微孔滤膜过滤,滤液待测。必要时可进行适当稀释。
5.1.2含油基质试样
称取混合均匀的待测试样1 g(精确到 0.001 g),置具塞锥形瓶中,加入25.0 mL石油醚,涡旋使充分混匀,过滤,弃去石油醚液,再用少量石油醚洗涤锥形瓶及滤纸,挥干,将滤纸和残渣置于原具塞锥形瓶中,加入50.0 mL流动相,称重,超声处理10 min,放冷,用流动相补足减失的重量,摇匀,经0.45 μm微孔滤膜过滤,滤液待测。必要时可进行适当稀释。
5.1.3 水性液体试样
吸取待测试样,必要时以流动相适当稀释,离心,取上清液经0.45 μm微孔滤膜过滤。
5.2色谱参考条件
5.2.1 色谱柱:C18柱,柱长250 mm,内径4.6 mm,粒径5 μm,或同等性能的色谱柱。
5.2.2流动相:甲醇+水=55+45。
5.2.3流速:1 mL/min。
5.2.4柱温:40℃。
5.2.5检测波长:293 nm。
5.2.6进样量:10 μL。
5.3 标准曲线的制作
将标准系列各浓度溶液(3.3.2),注入液相色谱仪中,测得相应的峰面积,以标准工作液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图A.1 )。
5.4 试样溶液的测定
将试样溶液(5.1.1、5.1.2、5.1.3)注入液相色谱仪中,以保留时间定性,同时记录峰面积,根据标准曲线得到待测液中芦荟苷的浓度(样品溶液液相色谱图见附录A中图A.2)。
6 结果计算
试样中芦荟苷含量按式(1)计算:
Ci×V ×100
Xi = ..........................................(1)
m×1000
式中:
Xi 试样中芦荟苷的含量,单位为克每百克(g/100 g)或克每百毫升(g/100 mL);
Ci——由标准曲线查得测定样液中芦荟苷的浓度,单位为毫克每毫升(mg/mL);
V 被测定样液的最终定容体积,单位为毫升(mL);
m 试样的称样质量,单位为克(g)或毫升(mL);
100——单位转换;
1000——单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
当称样量为1 g,定容体积为50 mL时,芦荟苷的定量限为0.0046g/100g。
附录 A
标准溶液和试样溶液典型液相色谱图
A.1 芦荟苷标准溶液色谱图,见图 A.1。
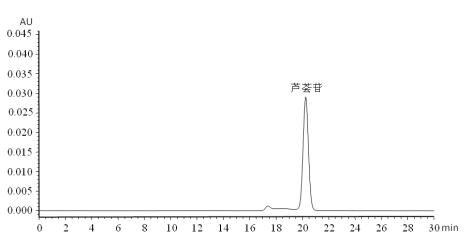
图 A.1 芦荟苷标准溶液色谱图
A.2 含有芦荟苷的试样溶液色谱图,见图 A.2。
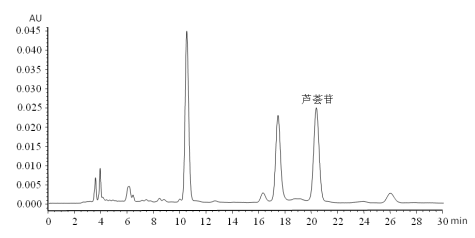
图 A.2 含有芦荟苷的试样溶液色谱图
四、保健食品中肉碱的测定
Determination of carnitine in health food
1范围
本方法规定了保健食品中肉碱的液相色谱测定方法。
本方法适用于以肉碱为主要原料的保健食品中肉碱的测定。
2原理
试样中的肉碱以0.5mmol/L的盐酸溶液经超声提取,反相色谱分离,以标准品的保留时间定性,外标法定量。
3试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 磷酸氢二钾(K2HPO4)。
3.1.2 辛烷磺酸钠(C8H19NaO3S)。
3.1.3 盐酸(HCl)。
3.1.4 磷酸(H3PO4)。
3.1.5硅藻土(SiO2):化学纯。
3.1.6乙腈(C2H3N):色谱纯。
3.2 试剂配制
3.2.1 盐酸溶液(0.50 mmol/L):吸取4.2mL盐酸,用水稀释并定容至100mL。再吸取上述溶液1mL,用水稀释并定容至1L。
3.2.2 缓冲盐溶液:分别称取8.7g磷酸氢二钾和0.4325g辛烷磺酸钠,用水溶解并稀释至1L,用磷酸调至pH2.5。
3.3 标准品
肉碱(C7H15NO3):纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
3.4 标准溶液配制
3.4.1 肉碱标准储备液(1.0mg/mL):精密称取肉碱标准品25 mg(精确到0.1mg)于25 mL容量瓶中,用盐酸溶液溶解并定容至刻度,摇匀。
3.4.2 肉碱标准工作液:分别准确吸取肉碱标准储备液0.50 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL于5 mL容量瓶中,用盐酸溶液稀释至刻度,得浓度为0.10 mg/mL、0.20 mg/mL、0.40 mg/mL、0.60 mg/mL、0.80 mg/mL、1.0 mg/mL的标准工作液。
4仪器
4.1 高效液相色谱仪:配有紫外(UV)检测器或二极管阵列(DAD)检测器。
4.2 天平:感量 0.1mg和0.01mg
4.3 超声波提取器。
5分析步骤
5.1 试样制备
5.1.1 试样处理
5.1.1.1 固体试样
称取粉碎并混合均匀的试样0.1 g~2 g (精确到0.001g)(含待测组分约5 mg~50 mg),于50mL容量瓶中,加入盐酸溶液约35mL,超声提取10min,放冷,用盐酸溶液稀释至刻度,混匀,过滤,弃初滤液数毫升,收集滤液,过0.45μm水相滤膜,取续滤液待测。
5.1.1.2 软胶囊试样
取试样剪开,挤出内容物并混匀,称取0.1 g~2 g(精确到0.001g),加入等量硅藻土,研至分散均匀,称取其中部分(精确到0.001g,含待测组分约5 mg~50 mg),转移至250 mL具塞三角瓶中,并吸取盐酸溶液50mL,并入三角瓶中,称重,加塞超声提取10 min,放冷,用盐酸溶液补足重量,混匀,过滤,弃初滤液数毫升,收集滤液,过0.45 μm水相滤膜,取续滤液待测。
5.1.1.3 液体试样
精密量取混匀后的试样1.0 mL~5.0 mL (含待测组分约5 mg~50 mg),于50 mL容量瓶中,加入盐酸溶液约35 mL,超声提取10 min,放冷,用盐酸溶液稀释至刻度,混匀,过滤,弃初滤液数毫升,收集滤液,过0.45 μm水相滤膜,取续滤液待测。
5.1.2 稀释
根据试样中肉碱含量用盐酸溶液进行适当的稀释(F),使待测溶液中肉碱的浓度在0.10 mg/mL~ 1.0 mg/mL。
5.2 色谱参考条件
5.2.1 色谱柱:C18柱:4.6×250mm,5μm或同等性能的色谱柱。
5.2.2 流动相:缓冲盐溶液+乙睛=90+10。
5.2.3 流速:0.8mL/min。
5.2.4 检测波长:210nm。
5.2.5 进样量:20μL。
5.3 标准曲线的制作
将肉碱标准工作液(3.4.2)从低浓度到高浓度分别注入高效液相色谱仪中,测定相应的峰面积。以标准工作液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图 A.1 )。
5.4待测溶液的测定
在相同色谱条件下,将待测溶液(5.1.1.1、5.1.1.2、5.1.1.3、5.2.1)注入高效液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线计算待测溶液中肉碱的浓度(待测溶液液相色谱图见附录A中图A.2)。
6 分析结果的表述
试样中肉碱含量按式(1)计算:

式中:
X——试样中肉碱的含量,固态试样单位为克每百克(g/100g),液态试样单位为克每百毫升(g/100mL);
ρ——根据标准曲线计算待测溶液中肉碱的浓度,单位为毫克每毫升(mg/mL);
V——试样稀释体积,单位为毫升(mL);
m——试样取样质量,单位为克(g);试样取样体积,单位为毫升(mL);
F——稀释倍数;
100——单位转换;
1000——单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%。
8 其他
当称样量为2.0 g,定容体积为50mL时,肉碱的定量限为0.10 g/100g。
当取样量为5.0mL,定容体积为50mL时,肉碱的定量限为0.040 g/100mL。
附录 A
标准溶液和待测溶液典型液相色谱图
A.1 肉碱标准溶液色谱图,见图 A.1。
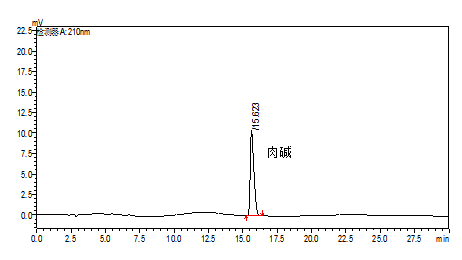
图A.1 肉碱标准溶液色谱图
A.2 含有肉碱的待测溶液色谱图,见图A.2。
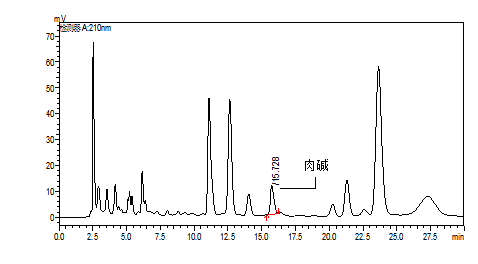
图A.2 含有肉碱的待测溶液色谱图
附录 A
标准溶液和待测溶液典型液相色谱图
A.1 肉碱标准溶液色谱图,见图 A.1。

图A.1 肉碱标准溶液色谱图
A.2 含有肉碱的待测溶液色谱图,见图A.2。
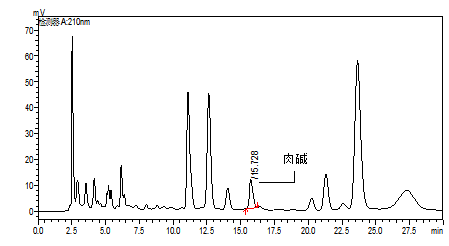
图A.2 含有肉碱的待测溶液色谱图
五、保健食品中α-亚麻酸、γ-亚麻酸的测定
Determination of α, γ-linolenic acids in health food
1 范围
本方法规定了保健食品中α-及γ-亚麻酸的测定方法。
本方法适用于油脂类保健食品中α-及γ-亚麻酸含量的测定。
本方法还适用于油脂类保健食品中C16~C22不饱和脂肪酸和角鲨烯含量的测定。
2 原理
将油脂试样(或试样提取的脂肪),经氢氧化钾皂化,在三氟化硼存在下甲醇酯化,然后用气相色谱仪分析,采用外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1正己烷(C6H14)。
3.1.2 氢氧化钾( KOH)。
3.1.3三氟化硼乙醚溶液。
3.1.4 甲醇(CH3OH):色谱纯。
3.1.5 氯化钠(NaCl)。
3.2 试剂配制
3.2.1氢氧化钾甲醇溶液 (0.5 mol/L):称取2.8 g氢氧化钾,用甲醇溶解并定容至 100 mL,混匀。
3.2.2三氟化硼甲醇溶液(1+4):取40%三氟化硼乙醚溶液1份,加甲醇4份,混匀即可。
3.2.3饱和氯化钠:饱和氯化钠溶液:称取360g氯化钠溶解于1.0L水中,搅拌溶解,澄清备用。
3.3.1 α-亚麻酸甲酯>99.0%。
3.3.2 γ-亚麻酸甲酯>99.0%。
3.3 标准溶液的配制
3.4.1 标准储备液(1.0 mg/mL):分别称取25.0mg α-亚麻酸甲酯及25.0mg γ-亚麻酸甲酯标准品,于25mL容量瓶中,用正已烷溶解并定容至刻度,摇匀。此溶液应贮存于-18°C 冰箱中。
3.4.2 标准使用液(0.5 mg/mL):分别吸取α-亚麻酸甲酯及γ-亚麻酸甲酯标准储备液各5.0mL于10mL的容量瓶中,混匀, 临用时配制。
4 仪器设备
4.1气相色谱仪,附氢火焰(FID)检测器。
4.2分析天平:感量0.1mg、1mg。
4.3加热式磁力搅拌器。
4.4标准磨口烧瓶(50mL)和直形冷凝管。
5 分析步骤
5.1试样制备
5.1.1脂肪的提取 按GB 5009.6中规定的方法提取。
5.1.2皂化
称取0.100g油脂(或脂肪)和磁力搅拌子一并放入50mL磨口烧瓶中(见图1),加入4mL0.5mol/L氢氧化钾甲醇溶液,上部连接回流冷凝管,并固定于磁力搅拌器上,由冷凝管上口向溶液中导入氮气;使反应瓶中始终充满氮气。开启磁力搅拌器,并加热使反应液保持65±5℃,搅拌回流约15min。
5.1.3甲脂化
从冷凝管上部加入4mL三氟化硼甲醇溶液,搅拌(65±5℃),回流约2min,冷至室温, 从冷凝管上部加入5mL正己烷继续搅拌5min,移去冷凝管,加入5mL饱和氯化钠水溶液, 摇动数分钟,转移至25mL分液漏斗中分离水与有机相,再加3mL正己烷洗水相,分离,弃水相,合并有机相并用正己烷定容至10.0mL(浓度低时吹氮浓缩至1.0mL)。供测定用。
5.2气相色谱参考条件
5.2.1色谱柱:FFAP(改性聚乙二醇20M,30m×0.25mmi.d.0.25μm)
5.2.2 柱箱温度:215℃。
5.2.3进样口温度:250℃。
5.2.4检测器温度:260℃。
5.2.5氮气:50mL/min,30:1分流;氢气:45mL/min;空气:500mL/min。
5.3定性分析
在上述仪器条件下,分别取标准使用液和试样测定液1.0μL,注入气相色谱仪,以保留时间来确定α-及γ-亚麻酸甲酯。
5.4定量分析
试样中α-亚麻酸甲酯或γ-亚麻酸甲酯色谱峰面积或峰高与标准的比较定量。
6 分析结果的表述
试样中α-亚麻酸甲酯或γ-亚麻酸测定结果按(1)式计算
6.1计算

..........................................(1)
式中:
X—α-亚麻酸或γ-亚麻酸含量,%;
A1—试样中α-亚麻酸甲酯或γ-亚麻酸甲酯色谱峰面积或峰高;
A2—标准使用液色谱峰面积或峰高;
ρ—标准使用液浓度,mg/mL;
v—正己烷定容体积,mL;
m—试样质量,g;
0.952—亚麻酸换算系数。
脂肪试样再换算原保健食品试样中γ-亚麻酸和α-亚麻酸的量。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
本方法最低检出量:γ-亚麻酸为0.050μg、α-亚麻酸为0.030μg。
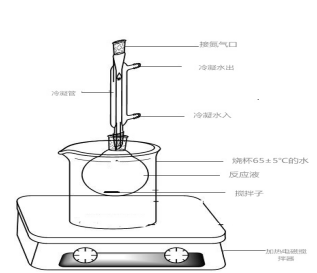
图 1皂化酯化装置图
附录 A
标准溶液和试样溶液典型气相色谱图
A.1 α-亚麻酸甲酯标准溶液色谱图,见图 A.1。

图 A.1 γ-亚麻酸甲酯 α-亚麻酸甲酯标准溶液色谱图
A.2 含有α-亚麻酸甲酯的试样溶液色谱图,见图 A.2。

图 A.2 含有α-亚麻酸甲酯的试样溶液色谱图
六、保健食品中人参皂苷的测定
Determination of ginsenosides in health food
1 范围
本方法规定了保健食品中人参皂苷的高效液相色谱测定方法。
本方法适用于以人参及其加工品为主要原料的保健食品中人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd含量的测定。
2 原理
将试样中的人参皂苷溶解、提取,经净化处理后,使用梯度洗脱反相高效液相色谱进行分离,紫外检测器检测,根据色谱峰的保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1 试剂
3.1.1 乙腈(CH3CN):色谱纯。
3.1.2 甲醇(CH3OH)。
3.1.3 D101大孔吸附树脂。
3.2 标准品
人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd:纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
3.3 标准溶液的配制
3.3.1 人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准储备液(10mg/mL):分别称取人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准品100mg于6个10.0mL容量瓶中,用甲醇溶解并定容至刻度,摇匀。
3.3.2 人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd混合标准工作液:分别吸取人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd标准储备液0.10mL、0.20mL、0.40mL、0.80mL、1.00mL于10.0mL容量瓶中,用甲醇定容,得浓度为0.10mg/mL、0.20 mg/mL、0.40 mg/mL、0.80 mg/mL、1.00 mg/mL的混合标准工作液。
4 仪器设备
4.1 高效液相色谱仪:附紫外检测器。
4.2 超声波清洗器。
4.3 离心机。
4.4 水浴锅。
4.5 分析天平:感量1mg和0.1mg。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
取试样研成粉末,并过20目筛。称取该粉末样适量(相当于含总人参皂苷约75mg,精确至0.001g),于50mL容量瓶中,加水45mL于超声波清洗器中超声提取30分钟,取出,待放至室温后,加水定容至刻度,摇匀,滤过,准确吸取续滤液10mL,通过D101大孔吸附树脂净化柱(大孔吸附树脂使用前先经甲醇浸泡,水洗,装成10cm长,直径1~1.5 cm的小柱),小柱先用10mL水冲洗,弃去水液之后,用70%甲醇25mL洗脱皂苷,收集甲醇溶液,水浴上蒸干,残渣以甲醇溶解并定容至5.0mL,该样液离心后过0.45μm膜,滤液进行色谱分析。
5.1.2 液体试样
取一定量的试样(相当于含总人参皂苷约75mg),于水浴上蒸干,残渣以50mL水超声提取30分钟,余下步骤与5.1.1相同。
5.2 色谱参考条件
5.2.1 色谱柱: C18柱,4.6 x 250 mm,5μm或同等性能的色谱柱。
5.2.2检测波长 203nm。
5.2.3 柱温:35°C。
5.2.4 进样量:5μl。
5.2.5 流动相:A相为乙腈,B相为水。
梯度洗脱条件
|
时间(min)
|
A相(%)
|
B相(%)
|
流速(mL/min)
|
|
0
|
16
|
84
|
1.0
|
|
20
|
18
|
82
|
1.0
|
|
55
|
40
|
60
|
1.0
|
|
65
|
40
|
60
|
1.0
|
|
66
|
100
|
0
|
1.0
|
|
71
|
100
|
0
|
1.0
|
|
72
|
16
|
84
|
1.0
|
|
85
|
16
|
84
|
1.0
|
5.3 标准曲线的制作
将5μL的混合标准工作液注入液相色谱仪中,测定相应的峰面积或峰高,以标准工作液的浓度为横坐标,以峰面积或峰高为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A)。
5.4 试样溶液的测定
将5μL的试样待测液注入液相色谱仪中,以保留时间定性,测得峰面积或峰高,根据标准曲线得到待测液人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd的浓度。
6 分析结果的表述
试样中各人参皂苷的含量按式(1)计算:
式中:
Xi——试样中各人参皂苷的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Ci——由标准曲线查得测定样液中各人参皂苷的浓度,单位为毫克每毫升(mg/mL);
V——被测定样液的最终定容体积,单位为毫升(mL);
F——被测定样液的稀释倍数;
m——试样的取样量,单位为克或毫升(g或mL);
100——单位转换;
1000——单位转换。
试样中总人参皂苷的含量按式(2)计算:
X总=XRe+XRg1+XRb1+XRc+XRb2+XRd………………(2)
式中:
X总—试样中总人参皂苷的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Xi—试样中各人参皂苷(Xi包括人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd)的含量,单位为克每百克或克每百毫升(g/100g或g/100mL)。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
8 其他
本方法中六种人参皂苷的最低检出量为10 mg/kg。
本方法中六种人参皂苷的最佳线性范围:0.1mg/mL~1mg/mL。
附录A
标准溶液典型液相色谱图
A.1 人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rd的标准溶液色谱图,见图A.1。

图A.1 人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rd的标准溶液色谱图
A.2 人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rd的样品溶液色谱图,见图A.2。

图A.2 人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rd的样品溶液色谱图
七、保健食品中原花青素的测定
Determination of procyanidins in health food
1 范围
本方法规定了保健食品中原花青素的测定方法。
本方法适用于保健食品中原花青素的含量测定。
2 原理
原花青素是含有儿茶素和表儿茶素单元的聚合物。原花青素本身无色,但经过热酸处理后,可以生成深红色的花青素离子。本法用分光光度法测定原花青素在水解过程中生成的花青素离子。计算试样中原花青素含量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH)。
3.1.2 正丁醇(CH3(CH2)3OH)。
3.1.3 盐酸(HCl)。
3.1.4 硫酸铁铵(NH4Fe(SO4)2·12H2O)
3.2 试剂配制
3.2.1盐酸(2 mol/L):取盐酸90mL,加水适量使成500mL,摇匀。
3.2.2 硫酸铁铵溶液:称取10g硫酸铁铵,用2 mol/L盐酸溶解并定容至500mL,混匀,此溶液中硫酸铁铵浓度为2%(w/v)。
3.3 标准品
原花青素(葡萄籽来源),纯度≥95%。
3.4 标准品溶液的配制
原花青素标准储备液(1.0 mg/mL):称取10 mg(精确至0.1 mg)原花青素标准品于10 mL 容量瓶中,用甲醇溶解并定容至刻度,摇匀。
4 仪器
4.1 天平:感量为 1 mg 和 0.1 mg。
4.2 分光光度计。
4.3 离心机:转速 ≥4000 r/min。
4.4 超声仪。
4.5 回流装置。
5 分析步骤
5.1 试样制备
5.1.1 固体试样:称取已粉碎混合均匀的待测试样50 mg~100 mg(精确至0.1 mg),置于50 mL容量瓶中,加入30 mL甲醇,超声处理20 min,放冷至室温后,加甲醇至刻度,摇匀,离心或放置至澄清后取上清液备用。
5.1.2 含油试样:称取混合均匀的待测试样50 mg(精确至0.1 mg),置于小烧杯中,用20 ~30mL甲醇分数次搅拌,将提取液转移至50 mL容量瓶中,直至甲醇提取液无色,加甲醇至刻度,摇匀。
5.1.3 液体试样:吸取不超过1 mL的待测试样,置于50 mL容量瓶中,加甲醇至刻度,摇匀。
5.2 试样测定
将正丁醇与盐酸按95:5的体积比混合后,取出6.0 mL置于具塞锥形瓶中,再加入0.2 mL硫酸铁铵溶液和1.0 mL试样溶液,混匀,置沸水浴回流,精确加热40 min后,立即置冰水中冷却,在加热完毕15 min后,于546 nm波长处测吸光度,由标准曲线计算试样中原花青素的含量。显色在1小时内稳定。
5.3 标准曲线制备
分别吸取原花青素标准储备液0 mL、0.1 mL、0.25 mL、0.5 mL、1.0 mL、1.5 mL置于10 mL容量瓶中,加甲醇至刻度,摇匀。各吸取1.0mL测定,与试样测定方法相同。绘制原花青素浓度与吸光度关系的标准曲线。
6 分析结果表述
试样中原花青素测定结果按(1)式计算
C×V×1000
X= ———————————×100………………..(1)
m×1000×1000
式中: X—试样中原花青素的含量, g/100g;
C—由标准曲线上查出待测试样中原花青素的浓度,μg/mL;
V—待测试样定容总体积, mL;
m—试样质量,g。
计算结果保留三位有效数字。
7 技术参数
精密度:在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
8 其他
本方法的定量限0.2mg/g。
八、保健食品中核苷酸的测定
Determination of nucleotide in health food
1 范围
本方法规定了保健食品中核苷酸的高效液相色谱测定方法。
本方法检出限:胞嘧啶核苷(CMP)0.04μg/ mL、脲嘧啶核苷(UMP)0.05μg/ mL、腺嘌呤核苷(AMP)0.05μg/ mL、鸟嘌呤核苷(GMP)0.06μg/ mL。
本方法线性范围:胞嘧啶核苷(CMP)0.992~12.4μg/ mL、脲嘧啶核苷(UMP)1.17~14.6μg/ mL、腺嘌呤核苷(AMP)1.01~12.6μg/ mL、鸟嘌呤核苷(GMP)0.948~12.3μg/ mL。
2 原理
将试样溶解、去除蛋白后,使用氨基固相萃取柱对核苷酸进行净化富集,根据高效液相色谱紫外检测器在254nm处的响应进行定性定量。
3 试剂
注:除特殊说明,所用试剂均为分析纯,实验用水符合GB/T 6682-2008一级水要求。
3.1 甲醇(CH3OH):优级纯。
3.2 乙酸:含C2H4O2应为36%~37%(g/g)。
3.3 磷酸二氢钾(KH2PO4)。
3.4 磷酸氢二钾(K2HPO4)。
3.5 季铵盐固相萃取柱。
3.6 核苷酸标准储备溶液:准确称量经100℃干燥4h处理的标准品胞嘧啶核苷(CMP)100mg,脲嘧啶核苷(UMP)、腺嘌呤核苷(AMP)、鸟嘌呤核苷(GMP)各40mg至100mL容量瓶中,加水溶解并定容至刻度 。
3.7 核苷酸标准使用液:将核苷酸标准储备溶液用0.25mol/L,pH=3的磷酸二氢钾溶液稀释100倍。
4 仪器设备
4.1 天平:感量为 1 mg 和 0.1 mg。
4.2 高效液相色谱仪(附二极管阵列或紫外检测器)。
5 分析步骤
5.1 试样处理
5.1.1 称取试样适量(相当于含核苷酸约6.5mg,精确至0.001g),于100mL容量瓶中,加入约50℃热水80mL,彻底混匀。当试样液达到室温后用水定容至刻度。
5.1.2 准确吸取10mL试样溶液至100mL容量瓶中,加入0.5%乙酸5mL、水10mL,混匀后静置5min以沉淀蛋白。用水定容至刻度,混匀后过滤,弃去数毫升初滤液后收集约30mL滤液。
5.1.3 将季铵盐固相萃取柱先用10mL甲醇、10mL水活化后,再将20mL试样滤液过滤,以1mL水清洗萃取柱,用0.25mol/L,pH=3.5磷酸二氢钾溶液洗脱出5mL滤液。全部过程需要控制流速1滴/秒。
5.2 液相色谱参考条件
5.2.1 色谱柱: C18 柱 3.9×150mm,5μm或同等性能色谱柱
5.2.2 柱温:25℃。
5.2.3检测波长 254nm。
5.2.4 流动相:0.01mol/L磷酸二氢钾—0.1mol/L磷酸氢二钾=480:20。
5.2.5 流速:0.6mL/min。
5.2.6 进样量:10mL。
5.2.7色谱分析:量取10μL标准溶液及试样溶液注入色谱仪中,以保留时间定性,以试样峰高或峰面积与标准比较定量。
5.3 标准曲线的制备:分别配制浓度为1.0、2.0、5.0、10.0、16.0μg/mL的4种核苷酸标准溶液,在给定的仪器条件下进行液相色谱分析,以峰高或峰面积对浓度作标准曲线。
6.结果计算
式中:
X—试样中核苷酸的含量,mg/100g;
h1—试样峰高或峰面积;
C—标准溶液浓度,μg/mL;
K—稀释倍数;
h2—标准溶液峰高或峰面积;
m—试样量,g。
试样中总核苷酸的含量为胞嘧啶核苷(CMP)、脲嘧啶核苷(UMP)、腺嘌呤核苷(AMP)、鸟嘌呤核苷(GMP)含量之和。
检测结果保留三位有效数字。
7.技术参数
在重复性条件下,获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
九、保健食品中洛伐他汀的含量测定
Determination of lovastatin in health food
1 范围
本方法规定了保健食品中洛伐他汀的液相色谱测定方法。
本方法适用于以红曲及其加工品为原料的保健品食品中内酯(闭环)洛伐他汀及酸式(开环)洛伐他汀的测定。
2 原理
试样经75% 乙醇溶液超声提取,采用液相色谱分离内酯(闭环)及酸式(开环)洛伐他汀,紫外检测器检测,以保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 无水乙醇(CH3CH2OH)。
3.1.3 磷酸(H3PO4)。
3.1.4 氢氧化钠(NaOH)
3.1.5 盐酸(HCl):质量分数约37 %。
3.2 试剂配制
3.2.1 75% 乙醇(v/v):将无水乙醇和水按75+25的体积比混合均匀。
3.2.2 0.2 mol/L氢氧化钠溶液:称取氢氧化钠1.6g,加水使溶解成200ml,即得。
3.2.3 0.2 mol/L盐酸溶液:吸取盐酸1.8ml,加水适量使成100ml,即得。
3.3 标准品
洛伐他汀(C24H36O5):CAS编号75330-75-5,纯度≥98%。
3.4 标准溶液的配制
3.4.1 洛伐他汀标准储备液(400 μg/mL):准确称取洛伐他汀标准品40 mg(精确至0.01 mg),用75% 乙醇溶解并定容至100 mL。
3.4.2 洛伐他汀标准系列。工作液:用流动相稀释,配制浓度为 8.0 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、160 μg/mL、320 μg/mL 的系列标准工作液。
3.4.3 定性用酸式(开环)洛伐他汀溶液:称取洛伐他汀(内酯)标准品4mg,用0.2mol/L氢氧化钠溶液定容至100 mL,在50℃条件下超声转化1h,放置到室温后再放置1h,用0.2mol/L 盐酸溶液调节pH至中性。
4 仪器设备
4.1 高效液相色谱仪:附二极管阵列或紫外检测器(UV)。
4.2 分析天平:感量为 1 mg 和 0.01 mg。
4.3 超声波清洗器。
4.4 涡旋混合器。
4.5 离心机:转速≥3500 r/min。
5 分析步骤
5.1 试样制备
将试样粉碎并混合均匀,称取试样适量(相当于含洛伐他汀约5 mg,精确至0.001g),置具塞锥形瓶中,精密加入50 mL 75%乙醇,密塞,称定重量,超声提取60 min,放冷,再称定重量,用75% 乙醇补足减失的重量,摇匀,以3500 r/min 的转速离心10 min,取上清液,经0.45 μm微孔滤膜过滤,滤液作为试样待测液。
5.2色谱参考条件
5.2.1 色谱柱:C18柱,4.6×250 mm,5 μm或同等性能色谱柱。
5.2.2 柱温:室温。
5.2.3 检测波长:238 nm。
5.2.4 流动相:甲醇+水+磷酸=385+115+0.14。
5.2.5 流速:1.0 mL/min。
5.2.6 进样量:10 μL。
5.3 标准曲线的制作
将10 μL的标准系列工作液分别注入液相色谱仪中,测得相应的峰面积,以标准系列工作液的浓度(μg/mL)为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 试验溶液的测定
将10 μL 试样待测液注入液相色谱仪中,以保留时间定性,测定被测组分峰面积,根据标准曲线得到待测液中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的浓度(μg/mL)。
6 分析结果的表述
6.1 试样中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的含量分别按式(1)计算:

式中:
Xi——试样中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的含量,单位为克每百克(g/100g);
Ci——被测定样液中内酯型(闭环)洛伐他汀或酸式(开环)洛伐他汀的浓度,单位为微克每毫升(μg/mL);
V——被测定样液的最终定容体积,单位为毫升( mL);
m——试样的称样质量,单位为克( g);
100——单位转换;
1000——单位转换。
6.2 试样中内酯型(闭环)洛伐他汀、酸式(开环)洛伐他汀的总含量按式(2)计算:

式中:
X——试样中内酯型(闭环)洛伐他汀和酸式(开环)洛伐他汀的总含量,单位为克每百克(g/100g);
X1——试样中内酯型(闭环)洛伐他汀的含量,单位为克每百克(g/100g);
X2——试样中酸式(开环)洛伐他汀的含量,单位为克每百克(g/100g);
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
当称样量为 0.5 g,定容体积为 50 mL时,洛伐他汀的定量限为0.040 g/100g。
附录A
标准溶液和试样溶液典型液相色谱图
A.1内酯型(闭环)洛伐他汀标准溶液色谱图,见图A.1。

图A.1 内酯型(闭环)洛伐他汀标准溶液色谱图
A.2酸式(开环)洛伐他汀标准溶液色谱图,见图A.2。

图A.2 酸式(开环)洛伐他汀标准溶液色谱图
A.3含有洛伐他汀的试样溶液色谱图,见图A.3。

图A.3 含有洛伐他汀的试样溶液色谱图
十、保健食品中植物类功效成分鉴别试验方法
Distinguish method of plant function component in health food
范围
本方法规定了保健食品中人参、西洋参、陈皮、甘草、大黄、银杏叶、芦荟、葛根等植物类功效成分的鉴别方法。
本方法适用于保健食品中人参、西洋参、陈皮、甘草、大黄、银杏叶、芦荟、葛根等植物类功效成分的鉴别。
一 陈皮
1 供试液制备
1.1 片剂或胶囊 称取研细的试样2 g,加甲醇20 mL,水浴上回流20 min或超声处理15 min,滤过,取滤液10 mL,浓缩至干,残渣加甲醇1 mL使溶解,作为供试品溶液。
1.2糖块:取本品30 g,加30 mL水使溶解,用稀盐酸调节pH至5~6,以水饱和的正丁醇提取3次(25 mL、25 mL、20 mL),合并正丁醇提取液,用水洗涤两次(30 mL、30 mL),取正丁醇液的1/3量置水浴上蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。
2 对照液制备
取陈皮对照药材0.3 g,同供试液制备1.1项下的方法处理,制成对照药材溶液。另取橙皮苷对照品适量,加甲醇制成饱和溶液,作为对照品溶液。
3 薄层板:用0.5%氢氧化钠溶液制备的硅胶G薄层板。
4 点样:供试液点样2μL~4 μL,对照品点样2 μL。
5 展开剂:(1)乙酸乙酯-甲醇-水(100:17:13)(2)甲苯-乙酸乙酯-甲酸-水(20:10:1:1)的上层溶液
6 展开方式:二次展开,先用展开剂(1)上行展开3 cm,取出,晾干,再以展开剂(2)上行展开8 cm,取出,晾干。
7 显色; 喷以3%三氯化铝乙醇溶液,略加热吹干,置紫外光灯(365 nm)下检视。
 |
8 色谱识别:供试品色谱除观察到橙皮苷荧光斑点外,供试品与对照药材在相同的位置上显相同颜色的荧光班点。在色谱的中部有明显的3个兰-兰白色荧光主斑点,为主要鉴别特征。
1 艾得康牌立即俏胶囊
2 陈皮对照药材
3 橙皮苷
二 大黄
1 供试液制备
取研细的片剂或胶囊粉末0.1 g,加甲醇20mL浸渍1 h,滤过,取滤液5 mL,蒸干,残渣加水10 mL使溶解,再加盐酸1mL,置沸水浴上加热回流30 min,立即冷却,用乙醚振摇提取2次,每次20 mL,合并乙醚液,蒸干,残渣加三氯甲烷1 mL使溶解,作为供试品溶液。
2 对照液制备
取大黄对照药材0.1 g,同供试液制备项下的方法处理,制成对照药材溶液。另取大黄酸对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。
3 薄层板:以0.3%羧甲基纤维素钠为黏合剂的硅胶H薄层板或硅胶G薄层板。
4 点样:各点样4 μL。
5 展开剂:石油醚(30~60℃)-甲酸乙酯-甲酸(15:5:1)的上层溶液
6 展开方式:上行展开8 cm。
7 显色; 紫外光灯(365 nm)下检视,再置氨蒸气中熏数分钟后,日光下检视。
 |
8 色谱识别:紫外光灯(365 nm)下检视,供试品色谱中,在与对照药材色谱相应的位置上,显相同的五个橙黄色荧光主斑点;在与对照品色谱相应的位置上,显相同的橙黄色荧光斑点。置氨蒸气中熏后,日光下检视,斑点变为红色。
1 金多靶减肥降脂素
2 大黄对照药材
三 甘草
1 供试液制备
1.1 固体试样
1.1.1 片剂及不含油的胶囊 称取研细的试样2 g,置于具塞锥瓶中,加乙醚40 mL,置水浴上加热回流1 h,滤过,弃去乙醚液,残渣加甲醇30 mL,加热回流1 h,滤过,滤液蒸干,残渣加水40 mL使溶解,用水饱和的正丁醇提取3次,每次20 mL,合并正丁醇液,用水洗涤3次,弃去水液,正丁醇液置水浴上蒸干,残渣加甲醇5 mL使溶解,作为供试品溶液。
1.1.2 含油胶囊 称取试样2 g,置于折叠滤纸上,用石油醚分数次洗去油脂,再将滤纸上的试样转入具塞锥形瓶中,按1.1.1项下自“加乙醚40 mL”起,依法操作。
1.1.3 糖块 取适量试样,加水40 mL使溶解,按1.1.1项下自“用水饱和的正丁醇提取3次”起,依法操作。
1.1 液体试样
取样10 mL,加水稀释至40 mL,按1.1.1项下自“用水饱和的正丁醇提取3次”起,依法操作。
2 对照液制备
取甘草对照药材1 g,同供试液制备1.1.1项下的方法处理,制成对照药材溶液。另取甘草酸单铵盐对照品,加甲醇制成每1 mL含2 mg的溶液,作为对照品溶液。
3 薄层板:用1%氢氧化钠溶液制备的硅胶G薄层板。
4 点样:各1 μL~2 μL。
5 展开剂:乙酸乙酯-甲醇-冰乙酸-水(15:1:1:2)
6 展开方式:展开箱用展开剂预平衡15 min,上行展开,展距8 cm。
7 显色; 喷以硫酸乙醇(1→10),105 ℃加热至斑点显色清晰,置紫外光灯(365 nm)下检视。
8 色谱识别:供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;在与对照品色谱相应的位置上,显相同的橙黄色荧光斑点。
 |
1 鹰牌川贝枇把糖
2 甘草对照药材
3 甘草酸
四 人参、西洋参
1 供试液制备
1.1 固体试样
1.1.1片剂及不含油的胶囊 称取研细的试样2 g,置于具塞锥瓶中,加三氯甲烷40 mL,置水浴上加热回流1 h,弃去三氯甲烷液,残渣挥干溶剂,加水0.5 mL搅匀湿润,加水饱和的正丁醇10 mL,超声处理30 min,吸取上清液,加氨试液(400→1000)3倍量,摇匀,放置分层,取上层液蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。
1.1.2含油胶囊 称取试样2 g,置于折叠滤纸上,用石油醚分数次洗去油脂,再将滤纸上的试样转入具塞锥瓶中,自“加三氯甲烷40 mL”起,依法操作。
1.2 液体试样
取试样10 mL,加水饱和的正丁醇20 mL,振摇提取,分取正丁醇层,加氨试液(400→1000)3倍量,摇匀,放置分层,取上层液蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。
2 对照液制备
取人参或西洋参对照药材约1 g,同供试液制备1.1.1项下的方法处理,制成对照药材溶液。另取人参皂苷Rb1、Re、Rg1、F11对照品,加甲醇制成每1 mL各含2 mg的混合溶液,作为对照品溶液。
3 薄层板:硅胶G薄层板。
4 点样:供试液2 μL~10 μL,对照液2 μL。
5 展开剂:三氯甲烷-乙酸乙酯-甲醇-水(15:40:22:10)10 ℃以下放置的下层液。
6 展开方式:展开槽内加入展开剂10 mL,槽内用硫酸控制相对湿度为42%(硫酸57 mL+水100 mL)。室温25 ℃,平衡15 min后,上行展开12 cm~14 cm,取出,晾干。
7 显色; 喷以硫酸乙醇溶液(1→10),在105 ℃加热至斑点显色清晰,分别置日光和紫外光灯(365 nm)下检视。
8 色谱识别:供试品的可见光色谱及荧光色谱与对照药材色谱基本相符,其中西洋参含有的人参皂苷F11,人参不含,而人参含有的人参皂苷Rf ,西洋参不含,可作为人参与西洋参鉴别的依据。对照品斑点自下而上依次为Rb1、Re、Rg1、F11,人参皂苷Rf位于人参皂苷Rg1、F11之间。

1. 二参含片(含人参、西洋参) 1. 虎哥牌生力胶囊(含人参)
2. 人参对照药材 2. 人参对照药材
3. 西洋参对照药材 3. 人参皂苷Rb1、Re、Rg1、F11
五 银杏叶
1 供试液制备
1.1 片剂及不含油的胶囊 称取研细成粉末的试样4 g,置于250 mL具塞锥瓶中,加50 %的丙酮100 mL,加热回流2.5 h,放冷,滤过,滤液蒸去丙酮,放冷,残液用乙酸乙酯振摇提取2次,每次50 mL,合并提取液,蒸干,残渣加15%乙醇2 mL使溶解,加于聚酰胺柱上(30~60目,2.5 g,柱内径1.5 cm,干法装柱),用5%乙醇200 mL洗脱,收集洗脱液,浓缩至50 mL,放冷,用乙酸乙酯提取2次,每次50 mL,合并提取液,蒸干,残渣加丙酮5 mL使溶解,作为供试品溶液。
1.2 含油胶囊 称取胶囊内容物4 g,置于折叠滤纸上,用石油醚分数次洗去油脂,挥干溶剂,将滤纸上的试样转入250 mL具塞锥瓶中,按1.1项下自“加50%的丙酮100 mL”起,依法操作。
1.3 冲剂 称取研细成粉末的试样4 g,加50%丙酮100 mL使溶解,用滤纸过滤,滤液蒸去丙酮,放冷,残渣用乙酸乙酯提取2次,每次50 mL,合并提取液,蒸干,用丙酮5 mL溶解残渣,作为供试品溶液。
2 对照液制备
取银杏内酯A、B、C及白果内酯对照品加丙酮制成每1 mL含0.5 mg的混合溶液,作为对照品溶液。
3 薄层板:用含4%醋酸钠的羧甲基纤维素钠溶液制备的硅胶H薄层板。
4 点样:供试品溶液和对照品溶液各点样5 μL,可增加供试品溶液的点样量以确定试样中是否含有银杏。
5 展开剂:甲苯-乙酸乙酯-丙酮-甲醇(10:5:5:0.6)
6 展开方式:在15 ℃以下展开,上行展开12 cm,取出,晾干。
7 显色; 用醋酐蒸气熏15 min,在140 ℃~160 ℃加热30 min,置紫外灯(365 nm)下检视。
8 色谱识别:供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。

|
1.试样Gincosan
2.益智灵
3.GIMKGO POWER
4.银杏内酯A、B、C、白果内酯
|
4. 银杏内酯A、B、C、白果内酯
5. 西洋参银杏叶茶
|
6. 日和素未检出银杏叶4μL
7. 日和素 8μL
8. 日和素 12μL
9. 银杏内酯A、B、C、白果内酯
|
六 葛根
1 供试液制备
1.1片剂或胶囊
1.1.1称取研细的试样2 g,加甲醇30 mL,放置2 h,滤过,滤液蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。
1.1.2按1.1.1制备的供试品溶液如果含有较多杂质,影响薄层色谱分离,可改用下述方法制备供试品液:称取研细的试样2 g,加乙醇40 mL,加热回流30 min,滤过,滤液蒸干,残渣加0.3%氢氧化钠溶液20 mL溶解并转移至分液漏斗中,用稀盐酸(234→1000)调节pH 5~6,用乙酸乙酯振摇提取2次,每次20 mL,合并提取液,用无水硫酸钠脱水,滤过,滤液蒸干,残渣加乙酸乙酯2 mL使溶解,作为供试品溶液。
1.2 液体试样
取混匀的试样20 mL,置分液漏斗中,用乙酸乙酯振摇提取两次,每次20 mL,合并提取液,用无水硫酸钠脱水,滤过,滤液蒸干,残渣加乙酸乙酯1 mL使溶解,作为供试品溶液。
2 对照液制备
取葛根素对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。
3 薄层板:以0.5%羧甲基纤维素钠为黏合剂的硅胶G薄层板。
4 点样:条带状点样,供试液5 μL~10 μL,对照液5 μL。如果试样中葛根素含量较低可增加点样量。
5 展开剂:三氯甲烷-甲醇-水(28:7:1)
6 展开方式:上行展开12cm,取出,晾干。
7 显色;置氨蒸气中熏15 min,置紫外灯(365 nm)下检视。
 |
8 色谱识别:供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光条斑。
1. 喜悦血燕美肌较囊
2. 葛根素
七 芦荟
1 供试液制备
固体试样或胶囊 取本品粉末2 g,加甲醇30 mL,水浴上加热至沸,振摇数分钟,滤过,滤液作为供试品溶液。
2 对照液制备
取芦荟苷对照品,加甲醇制成每1 mL含5 mg的溶液,作为对照品溶液。
3 薄层板:硅胶G薄层板。
4 点样:供试品溶液与对照品溶液分别点样1 μL~2 μL。
5 展开剂:乙酸乙酯-甲醇-水(100∶17∶13)。
6 展开方式:上行展开10 cm。
7 显色; 喷以10%氢氧化钾甲醇溶液,置紫外灯(365 nm)下检视。
8 色谱识别:供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。
 |
1. 金正方芦荟健康1号胶囊 1. 芦荟苷
2. 芦荟苷 2. 十八宝牌爱索菲胶囊
十一、保健食品中槲皮素、山柰素、异鼠李素的含量测定
Determination of quercetin、keampferol、isorhamnetin in health food
1 范围
本方法规定了保健食品中槲皮素、山柰素、异鼠李素的液相色谱测定方法。
本方法适用于以银杏叶或银杏叶提取物为主要原料的保健品食品中槲皮素、山柰素、异鼠李素的测定。
2 原理
试样经提取、水解等前处理后,采用液相色谱分离、紫外检测器检测,以保留时间定性,以外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 磷酸(H3PO4)。
3.1.3 盐酸(HCl):质量分数约37 %。
3.2 试剂配制
3.2.1 盐酸溶液(1.5 mol/L):取盐酸13.5 mL,加水适量使成100 mL,摇匀。
3.2.2 80%甲醇溶液:将甲醇和水按80+20的体积比混合均匀。
3.3 标准品
3.3.1 槲皮素(C15H10O7):CAS编号117-39-5,纯度≥98%。
3.3.2 山柰素(C15H10O6):CAS编号520-18-3,纯度≥98%。
3.3.3 异鼠李素(C16H12O7):CAS编号480-19-3,纯度≥98%。
3.3 标准溶液的配制
3.4.1 标准储备液(1 mg/mL):分别准确称取槲皮素、山柰素、异鼠李素标准品100 mg(准确至0.1 mg),于100 mL容量瓶中,用甲醇溶解并定容至刻度。
3.4.2 槲皮素、山柰素、异鼠李素混合标准中间液(200 μg/mL):分别准确吸取槲皮素、山柰素、异鼠李素标准储备液各5.00 mL于25 mL容量瓶中,用流动相定容。
3.4.3 混合标准系列工作液:分别准确吸取槲皮素、山柰素、异鼠李素混合标准中间液0.50 mL、1.00 mL、2.00 mL、3.00 mL和5.00 mL于10 mL容量瓶中,用流动相定容至刻度,配制成质量浓度分别为10 μg/mL、20 μg/mL、40 μg/mL、60 μg/mL、100 μg/mL 的混合标准系列工作液。
4 仪器设备
4.1 高效液相色谱仪:附二极管阵列或紫外检测器(UV)。
4.2 分析天平:感量为 1 mg 和 0.1 mg。
4.3 超声波清洗器:功率≥250W。
4.4 水浴锅。
5 分析步骤
5.1 试样制备
5.1.1 槲皮素、山柰素、异鼠李素的测定
取试样适量(相当于含槲皮素、山柰素、异鼠李素总量约3 mg,精确至0.001 g),加20 mL甲醇,超声提取30 min,滤过,残渣用甲醇约5 mL洗涤,洗液并入滤液,加入20 mL盐酸溶液(1.5 mol/L),水浴回流水解3 h,冷却,转移至50 mL容量瓶中,用甲醇定容至刻度,混匀,经0.45 μm微孔滤膜过滤,取续滤液,作为试样待测液。
5.1.2 游离槲皮素、山柰素、异鼠李素的测定
取试样适量(相当于含槲皮素、山柰素、异鼠李素总量约3 mg,精确至0.001 g),置具塞锥形瓶中,精密加入80%甲醇溶液20 mL,密塞,称定重量,超声提取(功率250W,频率33kHz)20 min,取出,放冷,再称定重量,用80%甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,作为试样待测液。
5.2色谱参考条件
5.2.1 色谱柱: C18 柱,5 μm,100 Å,3.9 mm ID×150 mm或同等性能色谱柱。
5.2.2 柱温:室温。
5.2.3 检测波长:360 nm。
5.2.4 流动相:甲醇+0.4%磷酸溶液=50+50。
5.2.5 流速:1.0 mL/min。
5.2.6 进样量:10 μL。
5.3 标准曲线的制作
将10 μL的混合标准系列工作液分别注入液相色谱仪中,测得相应的峰面积,以标准工作液的浓度(μg/mL)为横坐标,以峰面积为纵坐标,绘制标准曲线。
5.4 试验溶液的测定
将10 μL 试样待测液(5.1.1)注入液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线得到待测液中槲皮素、山柰素、异鼠李素的浓度(μg/mL);将10 μL 试样待测液(5.1.2)注入液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线得到待测液中游离槲皮素、山柰素、异鼠李素的浓度(μg/mL)。
6 分析结果的表述
6.1 试样中槲皮素、山柰素、异鼠李素的含量分别按式(1)计算:

式中:
Xi——试样中槲皮素或山柰素或异鼠李素的含量,单位为克每百克(g/100g);
Ci——被测定样液中槲皮素或山柰素或异鼠李素的浓度,单位为微克每毫升(μg/mL);
V——被测定样液的最终定容体积,单位为毫升( mL);
m——试样的称样质量,单位为克( g);
100——单位转换;
1000——单位转换。
6.2 试样中槲皮素、山柰素、异鼠李素的总含量按式(2)计算:

式中:
X——试样中槲皮素、山柰素、异鼠李素的总含量,单位为克每百克(g/100g);
X1——试样中槲皮素的含量,单位为克每百克(g/100g);
X2——试样中山柰素的含量,单位为克每百克(g/100g);
X3——试样中异鼠李素的含量,单位为克每百克(g/100g)。
6.3 试样中银杏叶总黄酮醇苷的含量按式(3)计算:

式中:
Y——试样中银杏叶总黄酮醇苷的含量,单位为克每百克(g/100g);
X——试样中槲皮素、山柰素、异鼠李素的总含量,单位为克每百克(g/100g);
2.51——换算因子。
6.4 试样中游离槲皮素、山柰素、异鼠李素的含量分别按式(4)计算:

式中:
Xi——试样中游离槲皮素或游离山柰素或游离异鼠李素的含量,单位为毫克每克(mg/g);
Ci——被测定样液中游离槲皮素或游离山柰素或游离异鼠李素的浓度,单位为微克每毫升(μg/mL);
V——被测定样液的最终定容体积,单位为毫升( mL);
m——试样的称样质量,单位为克( g);
1000——单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
当称样量为 0.5 g,定容体积为 50 mL时,本方法检测限分别为:槲皮素0.02 mg/g、山柰素0.03 mg/g、异鼠李素0.05 mg/g。
附录A
标准溶液和试样溶液典型液相色谱图
A.1槲皮素、山柰素、异鼠李素标准溶液色谱图,见图A.1。

图A.1 槲皮素、山柰素、异鼠李素标准溶液色谱图
A.2含槲皮素、山柰素、异鼠李素的试样溶液色谱图,见图A.2。

图A.2 含槲皮素、山柰素、异鼠李素的试样溶液色谱图
十二、保健食品中茶氨酸的测定
Determination of theanine in health food
1 范围
本方法规定了保健食品中茶氨酸的高效液相色谱测定方法。
本方法适用于红茶、绿茶等为主要原料的保健食品中茶氨酸含量的测定。
2 方法原理
. 将试样中的茶氨酸用水提取,使用等度洗脱,高效液相色谱分离,紫外检测器检测,峰面积或峰高定量,外标法计算结果。
3 试剂
注:除特殊说明,所用试剂均为分析纯,实验用水符合GB/T 6682规定一级水要求。
3.1 三氟乙酸(CF3COOH):色谱纯。
3.2 茶氨酸标准品(C7H14N2O3):CAS号3081-61-6,纯度≥98%。
3.3 三氟乙酸水溶液(pH 3.0):取水加三氟乙酸(3.1),调至pH 3.0。
3.4 茶氨酸标准储备液(3.5 mg/mL):称取35.0 mg茶氨酸标准品(精确到0.1 mg),用水溶解后,移入10 mL容量瓶,用水定容至刻度。
3.5 茶氨酸标准使用液:分别准确吸取茶氨酸标准储备液(3.4)0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL,移入10 mL容量瓶,用水定容至刻度。得到浓度分别为0.07 mg/mL、0.14 mg/mL、0.21 mg/mL、0.28 mg/mL、0.35 mg/mL茶氨酸标准使用液。
4 仪器设备
4.1 高效液相色谱仪:配有紫外检测器或二极管阵列检测器。
4.2 恒温水浴锅。
4.3 离心机,4000 r/min。
4.4 分析天平:感量1 mg,0.1 mg。
4.5 pH计。
5 分析步骤
5.1 固体试样的处理:称取粉碎试样适量(精确至0.001 g,相当于含茶氨酸10 mg),加水30 mL,在80 ℃的恒温水浴锅上加热40 min,冷却,离心,过滤后,转移至50 mL容量瓶,用水定容至刻度,混匀。试样溶液过0.45 μm水膜,待测。
5.2 液体试样的处理:取一定量的试样在水浴锅上蒸干,残渣用水溶解,转移至10 mL容量瓶,用水定容至刻度,混匀。溶液过0.45 μm水膜,待测。
5.3 色谱参考条件
5.3.1 色谱柱:C18柱,5 μm,4.6×250 mm或同效柱。
5.3.2 检测波长:203 nm。
5.3.3 流动相:三氟乙酸水溶液(3.3)。
5.3.4 流速:1.0 mL/min。
5.3.5 进样量:10.0 mL。
5.3.6 柱温:35 ℃。
5.4 色谱分析
5.4.1 标准曲线的制备:分别取标准使用液(3.5)浓度分别为0.07 mg/mL、0.14 mg/mL、0.21 mg/mL、0.28 mg/mL、0.35 mg/mL各10 μL进行HPLC分析,以标样浓度对峰面积绘制茶氨酸的标准回归曲线。
5.4.2 试样测定:将试样溶液注入高效液相色谱仪,以保留时间和紫外-可见吸收光谱定性,以峰面积定量,由色谱峰的峰面积可从标准曲线上求出相应的茶氨酸的浓度。
6结果计算
6.1试样中茶氨酸的含量
X= 


式中:
X—试样溶液中茶氨酸的含量,g/100g;
C—试样溶液中茶氨酸的浓度,mg/mL;
V—试样定容体积,mL;
m—试样质量,g。
6.2结果表示:计算结果保留三位有效数字。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,计算结果保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
本方法的最低检出量:10 ng。
附 录 A
(资料性附录)
茶氨酸标准样品液相色谱图
0.28 mg/mL茶氨酸标准溶液液相色谱图见图A.1。

图A.1 0.28 mg/mL茶氨酸标准溶液液相色谱图
十三、保健食品中五味子醇甲、五味子甲素和乙素的测定
Determination of schisandrin、deoxyschisandrin、schisandrin B in health food
1 范围
本方法适用于以五味子为主要原料生产的保健食品中五味子醇甲、五味子甲素和乙素含量的高效液相色谱测定。
2 原理
将试样中的木脂素提取后,使用等度洗脱反相高效液相色谱进行分离,二极管阵列检测器检测,根据色谱峰的保留时间和紫外光谱图定性,外标法定量。适用于以北五味子为主要原料生产的保健食品中五味子醇甲、五味子甲素和乙素定量分析。
3 试剂
注:除特殊说明,所用试剂均为分析纯,实验用水符合GB/T 6682-2008一级水要求。
3.1 甲醇(CH3OH):色谱纯。
3.2 五味子醇甲、五味子甲素和乙素标准品:含量均大于98%。
3.3 五味子醇甲、五味子甲素和乙素标准溶液的配制:配制五味子醇甲、五味子甲素和乙素标准储备液,浓度分别为2mg/mL,再以此储备液配制成混合标准系列溶液,浓度范围为0.02mg/mL~1mg/mL;所有标准溶液均用甲醇配制。
4 仪器
4.1 高效液相色谱仪:二极管阵列检测器或紫外检测器。
4.2 超声波清洗器。
4.3 分析天平:感量1mg,0.1mg。
5 分析步骤
5.1 试样处理:称取粉碎后样品适量(相当于含五味子总量30mg,精确至0.001g),置20mL容量瓶中,加入甲醇约18mL,超声提取20min,取出,静置待冷,加甲醇至刻度。试样溶液过0.45μm有机系滤膜,滤液进行色谱分析。
5.2 测定
5.2.1 液相色谱参考条件
5.2.1.1 色谱柱:C18柱,5μm,100Å,4.6×250mm或同等性能色谱柱。
5.2.1.2 检测波长:254nm。
5.2.1.3 等度淋洗条件:甲醇-水=77:23(v/v)。
5.2.1.4 流速:1mL/min。
5.2.1.5 柱温:35℃。
5.2.2 色谱分析
5.2.2.1 标准曲线的制备:将标准混合系列溶液均取10μL 进HPLC 分析,用峰面积对浓度计算五味子醇甲、五味子甲素和乙素的标准回归曲线。
5.3.2.2 试样测定:取10μL 试样净化液进行高效液相色谱分析,以绝对保留时间和紫外光谱图定性,用峰面积通过五味子醇甲、五味子甲素和乙素的标准曲线定量计算试样中的含量。
6分析结果的表述
试样中五味子醇甲、五味子甲素和乙素的含量按式(1)计算:
………………(1)
式中:X——试样中五味子醇甲、五味子甲素和乙素的含量,mg/100g;
C —— 试样溶液中五味子醇甲、五味子甲素和乙素的含量,mg/mL;
m —— 试样质量,g。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
本方法的检测限分别为五味子醇甲0.02μg,五味子甲素 0.03μg,五味子乙素0.02μg。
本方法的最佳线性范围为0.2-10μg。
十四、保健食品中腺苷的测定
Determination of adenosine in health food
1 范围
本方法规定了保健食品中腺苷的高效液相色谱测定方法。
本方法适用于保健食品中腺苷的测定。
2 原理
试样经水超声提取,用高效液相色谱进行测定,以保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 磷酸二氢钾(KH2PO4)。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 硅藻土(SiO2):化学纯。
3.2 试剂配制
0.01mol/L磷酸二氢钾溶液:称取1.36 g磷酸二氢钾,加水溶解并稀释至1000 mL。经0.45 μm微孔滤膜过滤后使用。
3.3 标准品
腺苷(C10H13N5O4):纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
3.4 标准溶液配制
3.4.1 腺苷标准储备液(1.0 mg/mL):精密称取10 mg (精确到0.1 mg)腺苷标准品于10 mL 容量瓶中,用水溶解并定容至刻度,摇匀。
3.4.2 腺苷标准中间液(100 μg/mL):精密吸取腺苷标准储备液2.5 mL于25 mL容量瓶中,用水稀释至刻度,摇匀。
3.4.3 腺苷标准工作液:精密吸取腺苷标准中间液0.1 mL、0.2 mL、0.5 mL、1.0 mL、2.0 mL、5.0 mL于10 mL容量瓶中,用水稀释至刻度,得浓度为1.0 μg/mL、2.0 μg/mL、5.0 μg/mL、10.0 μg/mL、20.0 μg/mL、50.0 μg/mL的标准工作液。
4 仪器设备
4.1 分析天平:感量为0.1 mg,0.01 mg。
4.2 超声波提取器。
4.3 离心机。
4.4 高效液相色谱仪:配有紫外(UV)检测器或二极管阵列(DAD)检测器。
5 分析步骤
5.1 试样制备
5.1.1 试样处理
5.1.1.1 固体试样
称取粉碎并混合均匀的试样0.5 g~2 g (精确到0.001 g) (含待测组分约0.05 mg ~2.5 mg)于50 mL容量瓶中,加入水约30 mL,超声提取20 min,放冷,用水稀释至刻度,摇匀,以3000 rpm/min离心5 min。经0.45μm水系滤膜过滤后,取续滤液供液相色谱分析用。
5.1.1.2 软胶囊试样
取试样剪开,挤出内容物并混匀,称取0.5 g~2 g (精确到 0.001 g),加入等量硅藻土,研至分散均匀,称取其中部分 (精确到0.001g,含待测组分约0.05 mg ~2.5 mg),转移至250 mL具塞三角瓶中,并吸取50 mL水,并入三角瓶中,称重,加塞超声提取20 min,放冷,用水补足重量,摇匀,静置澄清或以3000r/min离心5 min。取上清液经0.45 μm水系滤膜过滤后,续滤液供液相色谱分析用。
5.1.1.3 液体试样
精密量取混匀的试样5.0 mL ~10.0 mL (含待测组分约0.05 mg ~2.5 mg)于50 mL容量瓶中,加入水约30 mL,超声提取20 min,放冷,用水稀释至刻度,摇匀,以3000r/min离心5min。经0.45μm水系滤膜过滤后,取续滤液供液相色谱分析用。
5.1.2 稀释
根据试样中腺苷的含量用水进行适当的稀释(F),使待测溶液中腺苷浓度在1.0 μg/mL~50.0 μg/mL范围内。
5.2 液相色谱参考条件
5.2.1 色谱柱:C18柱4.6×250 mm,5 μm或同等性能色谱柱。
5.2.2 柱温:室温。
5.2.3 检测波长:254 nm。
5.2.4 流动相:甲醇+0.01mol/L磷酸二氢钾溶液=10+90。
5.2.5 流速:1.0 mL/min。
5.2.6 进样量:10 μL。
5.3 标准曲线的制作
将腺苷标准工作液(3.4.3)从低浓度到高浓度分别注入高效液相色谱仪中,测定相应的峰面积。以标准工作液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图A.1)。
5.4 试样溶液的测定
在相同色谱条件下,将待测溶液(5.1.1.1、5.1.1.2、5.1.1.3、5.1.2)注入高效液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线计算待测溶液中腺苷的浓度(待测溶液液相色谱图见附录A中图A.2)。
6 分析结果的表述
试样中腺苷含量按式(1)计算:

式中:
X——试样中腺苷的含量,固态试样单位为毫克每百克(mg/100g),液态试样单位为毫克每百毫升(mg/100 mL);
ρ——根据标准曲线计算得到的待测溶液中腺苷的浓度,单位为微克每毫升(μg/mL);
V——试样稀释或定容体积,单位为毫升(mL);
F——稀释倍数;
m——试样取样质量,单位为克(g);试样取样体积,单位为毫升(mL);
100——单位转换;
1000——单位转换。
计算结果以重复条件下获得的两次;测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
8 其他
当称样量为2.0g时,定容体积为50 mL时,腺苷的定量限为1.5mg/100g。
当取样量为10 mL时,定容体积为50 mL时,腺苷的定量限为0.30mg/100mL。
附录 A
标准溶液和待测溶液典型高效液相色谱图
A.1 腺苷标准溶液色谱图,见图A.1。

图A.1 腺苷标准溶液色谱图
A.2 含有腺苷的待测溶液色谱图,见图A.2。

图A.2 含有腺苷的待测溶液色谱图
十五、保健食品中总皂苷的测定
Determination of total ginsenosides in health food
1 范围
本标准规定了保健食品中总皂苷的分光光度测定方法。
本标准适用于保健食品中总皂苷含量的测定。
2 原理
试样用水提取总皂苷类成分,经大孔树脂柱或水饱和正丁醇萃取除杂后,试样中的皂苷类成分在高氯酸的作用下与香草醛反应,产生特征的紫红色,采用分光光度法测定560 nm波长处的吸光度,进行定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682 规定的一级水。
3.4 试剂
3.1.1 Amberlite-XAD-2 大孔树脂(或D-101大孔树脂)。
3.1.2 中性氧化铝:层析用(100-200目)。
3.1.3 正丁醇(CH3(CH2)2CH2OH)。
3.1.4 无水乙醇(CH3CH2OH)。
3.1.5 甲醇(CH3OH)。
3.1.6 氨水(NH3)。
3.1.7 高氯酸(HClO4)。
3.1.8 冰乙酸 (CH3COOH)。
3.1.9 香草醛(C8H8O3)。
3.2 试剂配制
3.2.1 香草醛溶液(5%):称取5g香草醛,加冰乙酸溶解并定容至100mL,混匀。
3.2.2 水饱和正丁醇溶液:取正丁醇适量,加入适量水,充分振摇,静置使分层,上层液体即为水饱和正丁醇。
3.2.3 氨试液:取氨水40mL,加水使成100mL,混匀。
3.3 标准品
人参皂苷Re (C48H82O18)。
3.4 标准溶液的配制
人参皂苷Re标准储备液(0.2 mg/mL):准确称取10.0 mg 人参皂苷Re标准品(精确至0.1 mg)于 50 mL容量瓶中,用甲醇溶解并定容至刻度,摇匀。
4 仪器设备
4.1 紫外/可见分光光度计。
4.2 天平:感量为 1 mg 和 0.1 mg。
4.3 超声波清洗器。
4.4 离心机:转速 ≥4000 r/min。
4.5 恒温水浴锅。
5 分析步骤
5.1 试样制备
5.1.1 试样处理
5.1.1.1 固体试样
称取已粉碎混合均匀的待测试样1 g(精确至 0.001 g)(或根据试样含总皂苷量定),置于具塞锥形瓶中,加入水100.0 mL,称重,超声30 min,放冷,再用水补足减失重量,摇匀,放置,滤过,续滤液备用。
5.1.1.2液体试样
含乙醇的液体试样,吸取混合均匀的待测试样10.0 mL(或根据试样含总皂苷量定)置水浴上挥尽乙醇后,用水转移至10mL容量瓶中,并用水稀释至刻度,备用;非乙醇类的液体试样,直接取样。
5.1.2 去除杂质(可根据样品性质选择以下一种方法)
5.1.2.1 大孔树脂柱层析法
用10 mL注射器作层析管,内装3cm大孔树脂,上加1 cm中性氧化铝。先用25 mL70%乙醇洗柱,弃去洗脱液,再用约25 mL水洗脱至无醇味,弃去洗脱液,加入1.0 mL已处理好的试样溶液(5.1.1.1,5.1.1.2),用25 mL水洗柱,弃去洗脱液,再用25 mL或以上70%乙醇洗脱人参皂苷至洗脱液无色,收集洗脱液于蒸发皿中,置于60℃水浴挥干,残渣用少量甲醇溶解并转移至10mL具塞比色管中,备用。
5.1.2.2 水饱和正丁醇萃取法
取5.1.1.1项下备用溶液25.0 mL置分液漏斗中;或将5.1.1.2项下备用溶液用水全部转移至分液漏斗中(非乙醇类液体试样直接取10.0 mL)并加水至约25mL。加入20 mL水饱和正丁醇(3.2.2)振摇萃取,分取正丁醇液(必要时可离心),重复操作3次,合并正丁醇液用20 mL氨试液(3.2.3)洗涤,重复操作2次,弃去氨试液,正丁醇液水浴蒸干,残渣用甲醇溶解并转移至25 mL量瓶中(液体样品则转移至10 mL量瓶中),加甲醇定容至刻度,摇匀,滤过,取续滤液,备用。
5.2 标准曲线的制作
吸取人参皂苷Re标准溶液(3.4)0 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL于10 mL具塞比色管中,置水浴中挥干溶剂,加入0.2 mL香草醛冰乙酸溶液(3.2.1),再加入0.8 mL高氯酸(3.1.7),混匀,使残渣全部溶解,置60℃水浴中加热10 min,取出,冰浴冷却后,加入5.0 mL冰乙酸(3.1.8),摇匀后,立即于560 nm波长处测定吸光度。
5.3 试样溶液的测定
取5.1.2.1项下备用溶液,或者吸取5.1.2.2 项下备用溶液1.0 mL于10 mL具塞比色管中,从5.2 “置水浴中挥干溶剂……”起,与标准溶液同法测定吸光度。
5.4 结果校正(如样品不存在背景干扰,无需校正)照5.1.2.1同法制备备用溶液,或者吸取5.1.2.2 项下备用溶液1.0 mL于10 mL具塞比色管中,置水浴中挥干溶剂,加入0.2 mL冰乙酸(3.1.8),从5.2 “再精密加入0.8 mL高氯酸(3.1.7)……”起,与试样同法测定吸光度,做试样背景校正。
6 分析结果的表述
试样中总皂苷含量(以人参皂苷Re计)按式(1)计算:
Ci ×V×100
Xi = ..........................................(1)
V0×m
式中:
Xi——试样中总皂苷的含量(以人参皂苷Re计),单位为毫克每百克(mg/100g)或毫克每百毫升(mg/100mL);
Ci——经试样背景校正后,由标准曲线算得被测液中人参皂苷Re质量,单位为毫克( mg);
V——被测定样液的定容体积,单位为毫升( mL);
V0——被测定样液的显色体积,单位为毫升( mL);
m——试样的称样质量,单位为克( g);
100——单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10% 。
8 其他
固体试样:当称样量为 1.0 g,定容体积为 100 mL时,总皂苷(以人参皂苷Re计)的定量限为0.5 mg/100g,液体试样:当取样量为1.0(或10.0)mL,定容体积为1(或10)mL时,总皂苷(以人参皂苷Re计)的定量限为0.005 mg/100mL。
十六、保健食品中总黄酮的测定
Determination of total flavonoid in health food
1 范围
本方法适用于以含黄酮类成分为主要原料的保健食品中总黄酮含量的测定。
2 原理
试样经预处理除杂后,以甲醇或60%乙醇溶液提取黄酮类成分。试样中的黄酮类成分可被亚硝酸钠还原,与硝酸铝生成络合物,在氢氧化钠溶液碱性条件下开环,生成 2-羟基查耳酮而使溶液显特征的橙红色,采用分光光法在510nm波长处测定吸光度,以芦丁为对照品,采用标准曲线法计算样品中总黄酮的含量。
3 试剂
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682 规定的一级水。
3.1 5%亚硝酸钠溶液:称取5g亚硝酸钠(NaNO₂),加水溶解成100mL。
3.2 10%硝酸铝溶液:称取硝酸铝(Al(NO3)3•9H2O)10g,加水溶解成100mL。
3.3 氢氧化钠试液:取氢氧化钠(NaOH)4.3g,加水溶解成100mL。
3.4 石油醚(60~90℃)。
3.5 乙醇(CH3CH2OH)。
3.6 甲醇(CH3OH)。
3.7 芦丁对照品溶液: 取芦丁对照品适量,精密称定,加甲醇溶解,制成浓度为0.2mg/mL的对照品溶液。
4 仪器
4.1 紫外/可见分光光度计。
4.2 超声波提取器。
4.3 离心机。
4.4 分析天平:感量1mg,0.1mg。
5 分析步骤
5.1 试样处理(试样取样量、供试液取样体积可根据试样中总黄酮的含量适当调整,以保证测定的吸收度值在0.3~0.7范围内)
5.1.1 固体与软胶囊试样:精密称取固体试样粉末或软胶囊内容物0.4g(M),置索氏提取器中,加石油醚(60~90℃)加热回流提取至提取液无色,弃去石油醚液,样渣挥去石油醚,转移至具塞锥形瓶中,精密加甲醇25mL(V1),密塞,称定重量,超声处理30分钟,放冷至室温,称定重量,用甲醇补足减失的重量,摇匀,离心,取上清液作为供试品溶液。
5.1.2 液体试样:精密吸取供试品2mL(M),至25mL(V1)量瓶中,加60%乙醇溶解并稀释至刻度,摇匀,作为供试品溶液。
5.2 芦丁对照品标准曲线制备:精密吸取芦丁对照品溶液(3.7项)0.0,1.0,2.0,3.0,4.0,5.0,6.0mL,分别置25mL(V3)量瓶中,加水至6mL,加入5%亚硝酸钠溶液1mL,摇匀,放置6min,加10%硝酸铝溶液1mL,摇匀放置6min,加氢氧化钠试液10mL,摇匀,再加水至刻度,摇匀,放置15分钟,以0.0mL对照品溶液制得的溶剂为空白,在波长510nm处分别测定吸光度值。以吸光度为纵坐标(A),对照品浓度为横坐标(mg/mL),绘制标准曲线。
5.3 样品测定:精密吸取供试品溶液2mL(V2),至25mL量瓶中;照5.2,自加水至6mL起,……,至在510nm波长处测定吸光度,同法操作。从标准曲线上读出供试品溶液中含总黄酮的浓度(C),计算样品中总黄酮的含量(X)。
6 分析结果的表述
C×V1×V3×100
X = ————————
V2×M×1000
式中:
X—试样中总黄酮百分含量,以芦丁(C27H30O16)计, g/100g(mL);
C—标准曲线上读出供试品溶液中总黄酮的浓度,mg/mL;
V1—试样定容体积,mL;
V2—吸取供试液体积,mL;
V3—显色定容体积,mL;
M—试样取样量,g(mL)。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
同一操作者两次平行测试结果的绝对差值不得超过算数平均值的: 15%(固体样品)、10%(液体样品)。
注:样品有颜色时,可采用样品标准添加法,以0号管调零,绘制标准曲线,以消除样品颜色干扰。
8 其他
本方法的检测限(LOD)为50ng;定量限(LOQ)200ng;
本方法的最佳线性范围(以芦丁计):9.9~59.2最佳线性范围。
十七、保健食品中壳聚糖脱乙酰度的测定
Determination of deacetylationg degree of chitosan in health food
1 范围
本方法规定了保健食品中壳聚糖脱乙酰度的电位滴定测定方法。
2 原理
用过量的盐酸溶液溶解脱乙酰甲壳素试样,盐酸与脱乙酰甲壳素中的氨基等摩尔结合后,溶液中含有过量的盐酸。用氢氧化钠溶液滴定时,氢氧化钠首先中和过量的盐酸,溶液pH 发生变化,即第一个“突跃”,然后氢氧化钠再中和与脱乙酰甲壳素中氨基结合的盐酸,达到滴定等电点时,溶液pH 出现第二个“突跃”,由两个“突跃”之间消耗的氢氧化钠量计算出试样中的氨基含量,从而得到试样的脱乙酰基度。
3 试剂和材料
3.1 盐酸标准滴定液:c(HCl)=0.1 mol/L。
3.2氢氧化钠标准滴定溶液:c(NaOH)=0.1 mol/L。
4 仪器设备
4.1 电磁搅拌器。
4.2 酸度计或电位滴定仪。
4.3 天平:感量1mg。
4.4 电热干燥箱。
5 分析步骤
5.1 试样处理
称取于105°C ± 2°C烘干至恒重的试样0.2 g,精确至0.0001 g,加入30 mL 盐酸标准滴定溶液,搅拌至完全溶解,再加50 mL 水,混匀。
5.2 滴定
用氢氧化钠标准滴定溶液滴定5.1得到的溶液,测其pH,每滴加0.5 mL 记录一次。当滴加至pH接近“突跃”时,逐滴滴定,记录氢氧化钠标准滴定溶液的体积和相应的pH,得到pH-氢氧化钠标准滴定溶液体积曲线,找出其“突跃”点。记录两次突跃点间所消耗的氢氧化钠标准滴定溶液的体积数值。
6 分析结果的表述
脱乙酰度的质量分数w按公式 ( 1 ) 计算:

式中:
ΔV——二个“突跃”点之间消耗的氢氧化钠标准滴定溶液的体积,单位为毫升( mL );
c ——氢氧化钠标准滴定溶液的浓度,单位为摩尔每升( mol/L );
10-3——单位换算系数;
16——氨基的摩尔质量,单位为克每摩尔( g/moL );
m ——试样中壳聚糖的质量,单位为克( g );
0.0994——理论氨基含量( 16/161 )。
实验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的2%。
十八、蚓激酶活性的测定方法
Determination of activity of lumbrokinase
1 范围
本标准规定了蚓激酶粉中蚓激酶活性的测定方法。
2 原理
由于蚓激酶粉具有直接和间接溶解血纤维蛋白的作用,本方法采用琼脂糖—纤维蛋白平板法,通过蚓激酶标准品得到线性方程,将样品带入线性方程计算其中蚓激酶的效价。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 磷酸氢二钠(Na2HPO4·12H2O)。
3.1.2 磷酸二氢钠(NaH2PO4·2H2O)。
3.1.3 氯化钠(NaCl)。
3.1.3 盐酸(HCl)。
3.1.4 纤维蛋白原。
3.1.5 凝血酶。
3.1.6 蚓激酶对照品。
3.1.7 琼脂糖。
3.2 试剂配制
3.2.1 0.01 mol/L磷酸盐缓冲液:取磷酸氢二钠3.58 g,加水使溶解并稀释至100 mL为A液;取磷酸二氢钠0.78 g,加水使溶解并稀释至500 mL为B液;将A、B两液混合至pH7.8。
3.2.2 工作溶液:取0.01 mol/L磷酸盐缓冲液(pH7.8)与0.9%氯化钠溶液(1:17)混合。
3.2.3 1.5%琼脂糖液:取琼脂糖1.5 g,加工作溶液100 mL溶解。
3.2.4 纤维蛋白原液:取纤维蛋白原适量,加工作溶液制成每1 mL中含1.5 mg纤维蛋白原的溶液。
3.2.5 凝血酶溶液:取凝血酶适量,加0.9%氯化钠溶液制成每1 mL含有1 BP单位的溶液。
3.2.6 琼脂糖-纤维蛋白原平板制备: 取纤维蛋白原溶液39 mL,置烧杯中,边搅边加入55 °C琼脂糖溶液39 mL,凝血酶溶液3.0 mL,立即混匀,快速倒入直径14 cm的塑料培养皿中,室温水平放置1小时,打孔,备用。
3.2.7 标准品溶液制备: 取蚓激酶标准品,用0.9%氯化钠溶液制成浓度分别为每1 mL中含有10000、8000、6000、4000、2000蚓激酶单位的溶液。
3.2.8 试样溶液制备: 取样品适量,研细,精密称定,加0.9%氯化钠溶液超声10 min,定容、摇匀。取上清液,根据标准曲线范围进行适当稀释。
4 仪器设备
4.1 恒温培养箱。
4.2 不绣钢小管,φ3 mm。
4.3 天平:感量1 mg。
4.4 pH计。
5 分析步骤
精密量取蚓激酶标准品溶液和试样溶液各10 µL,分别点在同一琼脂糖-纤维蛋白原平板上不同的小孔中,加盖,置37°C恒温箱中反应18小时,取出后用卡尺测量溶菌圈垂直直径(取平均值计算溶圈面积)。以蚓激酶标准品单位数的对数为横坐标,溶圈面积的对数为纵坐标,计算标准曲线回归方程,将供试品溶圈面积的对数带入标准曲线回归方程,计算供试品效价单位数。标准品与样品应各做两点取平均值。
6 分析结果的表述
按下列公式计算蚓激酶的活性:
S=(D/2)2×3.14
lgS = a×lgU + b
其中:
S ——溶圈的面积,单位为mm2;
D——溶圈的直径,单位为mm;
U——蚓激酶的活性,单位为U/mL;
a——蚓激酶标准品计算得到的线性方程斜率;
b——蚓激酶标准品计算得到的线性方程截距。
十九、保健食品中总蒽醌的测定
Determination of total anthraquinone in health food
1 范围
本方法规定了保健食品中总蒽醌的分光光度测定方法。
本方法适用于保健食品中总蒽醌的测定。
2 原理
试样经酸水解后,有机溶剂提取总蒽醌,利用羟基蒽醌衍生物在碱性溶液中显红-紫红色反应(Borntrager反应) ,采用分光光度法,以标准曲线定量检测。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T 6682 规定的三级水。
3.5 试剂
3.1.1 盐酸(HCl)
3.1.2 氨水(NH3·H2O)
3.1.3 二氯甲烷(C2H6Cl2)
3.1.4 氢氧化钠(NaOH)
3.1.5 甲醇 (CH3OH)
3.2 试剂配制
3.2.1 25%盐酸:取盐酸68 mL,加水稀释至100 mL。
3.2.2 4%氨溶液:取氨水16 mL,加水稀释至100 mL。
3.2.3 10%氢氧化钠溶液:称取氢氧化钠10g,加水溶解并定容至100 mL。
3.2.4 混合碱溶液:等体积10%氢氧化钠和4%氨溶液混合。
3.3 标准品
1,8-二羟基蒽醌:纯度≥99.0%。
3.4 标准溶液的配制
1,8-二羟基蒽醌标准溶液:精密称取1,8-二羟基蒽醌标准品10mg,置25mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成0.4mg/mL的溶液。
4 仪器设备
4.1 分光光度计
4.2 天平:感量为 1 mg 和 0.1 mg。
4.3 恒温水浴锅
5 分析步骤
5.1 标准曲线
分别精密吸取1,8-二羟基蒽醌标准溶液0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL于25mL容量瓶中,加混合碱溶液至刻度,混匀,于暗处放置30分钟。以混合碱溶液为空白,在525nm波长处,分别测定吸光度。以浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
5.2试样测定
称取已粉碎混合均匀的待测试样0.1~0.5g(相当于每g含总蒽醌2mg~17mg),精密称定,置100mL圆底烧瓶中,精密加入甲醇-盐酸(10:1)混合溶液25mL,称重,在80℃水浴中加热回流30分钟,放冷,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液15mL至分液漏斗中,加水25mL,用二氯甲烷160mL提取4次(50mL,50mL,30mL,30mL),合并二氯甲烷液,并用水洗涤至中性,弃去水洗液,二氯甲烷层转移至蒸发皿中蒸干,用甲醇将残渣溶解并转移至10mL容量瓶中,用甲醇定容至刻度,摇匀,作为试样溶液。精密量取试样溶液2mL, 置25mL量瓶中,加混合碱溶液至刻度,混匀,置暗处放置30分钟,取出,迅速冷却至室温,称重,补加混合碱溶液到原来重量,摇匀,测定吸光度。根据回归方程计算试样中总蒽醌的含量。
6 分析结果的表述
试样中总蒽醌含量按式(1)计算:
C×V×100
X = ..........................................(1)
m
式中:
X——试样中总蒽醌的含量,单位为毫克每百克(mg/100g);
C——由标准曲线查得测定试样中总蒽醌的浓度,单位为毫克每毫升( mg/mL);
V——被测定试样的最终定容体积,单位为毫升( mL);
m——试样的称样质量,单位为克( g);
100——单位转换;
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%。
8 其他
本方法的检出限为1.3μg。
二十、保健食品中10-羟基癸烯酸的测定
Determination of 10-hydroxy-2-decenoic acid in health food
1 范围
本方法规定了保健食品中10-羟基癸烯酸的高效液相色谱测定方法。
本方法适用于保健食品中10-羟基癸烯酸的测定。
2 原理
试样经乙醇或甲醇提取后,用高效液相色谱进行测定,以保留时间定性,峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1盐酸(HCL)。
3.1.2 甲醇(CH3OH):色谱纯。
3.1.3 无水乙醇(C2H6O)。
3.2 试剂配制
3.2.1 0.1mol/L盐酸:量取盐酸9mL,缓慢注入1000mL水。
3.2.2 0.03mol/L盐酸:量取0.1mol/L盐酸300mL,加入700mL水。
3.2.3 0.01mol/L盐酸:量取0.1mol/L盐酸100mL,加入900mL水。
3.3 标准品
10-羟基-2-癸烯酸(C10H18O3):纯度≥98%,或经国家认证并授予标准物质证书的标准物质。
3.4 标准溶液的配制
3.4.1 10-羟基癸烯酸标准储备液(1.0mg/mL):精密称取10 mg (精确到0.1 mg) 10-羟基-2-癸烯酸标准品于10 mL 容量瓶中,用无水乙醇溶解并定容至刻度,摇匀。
3.4.2 10-羟基癸烯酸标准工作液:分别准确吸取10-羟基癸烯酸标准储备液0.02 mL、0.1 mL、0.2 mL、0.5 mL、1.0 mL 于 10.0 mL容量瓶中,用无水乙醇稀释至刻度,得浓度为2.0 μg/mL、10.0 μg/mL、20.0 μg/mL、50.0 μg/mL、100.0μg/mL的标准工作液。
4 仪器设备
4.1 分析天平:感量0.1mg,0.01mg。
4.2 超声波提取器。
4.3 离心机。
4.4 高效液相色谱仪:配有紫外(UV)检测器或二极管阵列(DAD)检测器。
5 分析步骤
5.1 试样制备
5.1.1 试样处理
5.1.1.1 固体试样
称取粉碎并混合均匀的试样0.5 g~2 g (精确到0.001 g) (含待测组分约0.1 mg ~5 mg)于50 mL容量瓶中,加0.01mol/L盐酸2 mL,加无水乙醇30 mL,超声提取20 min,放冷,用无水乙醇稀释至刻度,摇匀,在3000r/min下离心10 min。经0.45μm有机系滤膜过滤后,取续滤液供液相色谱分析用。
5.1.1.2 软胶囊试样
取试样剪开,挤出内容物并混匀,称取0.5 g~2 g (精确到 0.001 g), 加入等量硅藻土,研至分散均匀,称取其中部分(精确到0.001g,含待测组分约0.1 mg ~5 mg),转移至250 mL具塞三角瓶中,并吸取0.01mol/L盐酸2 mL,无水乙醇48 mL,并入三角瓶中,称重,加塞超声提取20 min,放冷,用无水乙醇补足重量,摇匀,静置澄清或取部分混悬液3000r/min离心10 min。经0.45μm有机系滤膜过滤后,取续滤液供液相色谱分析用。
5.1.1.3 液体试样
精密量取混匀的试样5.0 mL ~10.0 mL (含待测组分约0.1 mg ~5 mg)于50 mL容量瓶中,加甲醇30 mL,超声提取20 min,放冷,用甲醇稀释至刻度,摇匀,在3000r/min下离心10 min。经0.45μm有机系滤膜过滤后,取续滤液供液相色谱分析用。
5.1.2 稀释
根据试样中10-羟基癸烯酸的含量用相应溶剂进行适当的稀释(F),使待测溶液中10-羟基癸烯酸浓度在2.0 μg/mL~100.0 μg/mL范围内。
5.2 液相色谱参考条件
5.2.1 色谱柱:C18柱4.6×250mm,5μm或同等性能色谱柱。
5.2.2 柱温:35℃。
5.2.3 检测波长:210nm。
5.2.4 流动相:甲醇+0.03mol/L盐酸+水=55+10+35。
5.2.5 流速:1.0mL/min。
5.2.6 进样量:10μL。
5.3 标准曲线的制作
将10-羟基癸烯酸标准工作液(3.4.2)从低浓度到高浓度分别注入高效液相色谱仪中,测定相应的峰面积。以标准工作液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图A.1)。
5.4 待测溶液的测定
在相同色谱条件下,将待测溶液(5.1.1.1、5.1.1.2、5.1.1.3、5.1.2)注入高效液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线计算待测溶液中10-羟基癸烯酸的浓度(待测溶液液相色谱图见附录A中图A.2)。
6 分析结果的表述
试样中10-羟基癸烯酸含量按式(1)计算:

式中:
X——试样中10-羟基癸烯酸的含量,固态试样单位为克每百克(g/100g),液态试样为克每百毫升(g/100mL);
ρ——根据标准曲线计算得到的待测溶液中10-羟基癸烯酸的浓度,单位为微克每毫升(μg/mL);
V——试样稀释或定容体积,单位为毫升(mL);
m——试样取样质量,单位为克 (g);试样取样体积,单位为毫升(mL);
F——稀释倍数;
100——单位换算;
1000——单位换算。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的5%。
8 其他
当称样量为2.0 g时,定容体积为50 mL时,10-羟基癸烯酸的定量限为0.5 mg/100g。
当取样量为10.0 mL时,定容体积为50 mL时,10-羟基癸烯酸的定量限为0.1 mg/100mL。
附录 A
标准溶液和待测溶液典型高效液相色谱图
A.1 10-羟基-2-癸烯酸标准溶液色谱图,见图A.1。

图A.1 10-羟基-2-癸烯酸标准溶液色谱图
A.2 含有10-羟基-2-癸烯酸的待测溶液色谱图,见图A.2。

图A.2 含有10-羟基-2-癸烯酸的待测溶液色谱图
二十一、保健食品中绞股蓝皂苷XL IX的测定
Determination of gypenoside XL IX in health food
1 范围
本标准规定了保健食品中绞股蓝皂苷XL IX的高效液相色谱测定方法。
本标准适用于以绞股蓝及其加工品为主要原料的保健食品中绞股蓝皂苷XL IX含量的测定。
2 原理
试样经过甲醇提取后,采用高效液相色谱法测定,根据保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为色谱纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 甲醇(CH3OH)。
3.1.2 乙腈(CH3CN)。
3.2 标准品
绞股蓝皂苷XL IX (C52H86O21,CAS号:94987-08-3):纯度≥99.0%。
3.3 标准溶液的配制
3.3.1 绞股蓝皂苷XL IX标准储备液(5 mg/mL):称取在60 ± 5 °C,40 kpa~53 kpa条件下减压干燥3 h的绞股蓝皂苷XL IX标准物质25 mg (精确至0.01 mg)于 5 mL 容量瓶中,用甲醇溶解并定容至刻度,摇匀。此溶液应贮存于-18°C 冰箱中。
3.3.2 绞股蓝皂苷XL IX标准工作液:吸取绞股蓝皂苷XL IX标准储备液适量配置浓度分别为0.005 mg/mL、0.01 mg/mL、0.02 mg/mL、0.1 mg/mL、0.5 mg/mL、1 mg/mL 、2 mg/mL的标准工作液,临用时配制。
4 仪器设备
4.1 高效液相色谱仪:带紫外或二极管阵列检测器。
4.2 天平:感量为0.1 mg 和 0.01 mg。
4.3 超声波清洗器:功率为800W。
4.4 微孔滤膜:0.45 μm,有机相。
5 分析步骤
5.1 试样制备
5.1.1 固体试样
取20粒以上片剂或胶囊试样进行粉碎、混匀,或取半固态试样混匀(软胶囊称取内容物),准确称取均匀试样0. 5 g (精确至0.0001 g) 置具塞试管中,精密加入甲醇10 mL,密塞,超声处理5 min,冷却至室温,摇匀,过滤膜(0.45 μm,有机相),取滤液,待测。
5.1.2 液态试样
移取摇匀的试样0.5 mL于10 mL容量瓶中,加入甲醇8 mL,超声处理5 min,冷却至室温,用甲醇定容至10 mL,过滤膜(0.45 μm,有机相),取滤液,待测。
5.2 色谱参考条件
5.2.1 色谱柱:十八烷基硅烷键合硅胶柱,柱长100 mm,内径4.6 mm,粒径3 μm,或性能相当者。
5.2.2 流动相:以乙腈为流动相A,以水为流动相B,按表1 中的规定进行梯度洗脱。
表1 流动相梯度洗脱表
|
时间(min)
|
流速(mL/min)
|
流动相A(%)
|
流动相B(%)
|
|
0
|
0.5
|
25
|
75
|
|
15
|
0.5
|
35
|
65
|
|
35
|
0.5
|
45
|
55
|
|
40
|
0.5
|
45
|
55
|
|
41
|
0.5
|
25
|
75
|
5.2.3 检测波长:203 nm 。
5.2.4 柱温:40 °C。
5.3 系统适用性
理论塔板数按绞股蓝皂苷XL IX峰计算应不低于10000。
5.4 标准曲线的制作
将10 μL的标准系列各浓度溶液(3.3.2) ,以峰面积为纵坐标,以标准工作液中绞股蓝皂苷XL IX的浓度为横坐标,绘制标准曲线。(标准溶液液相色谱图见附录A中图A.1 )。
5.5 试样溶液的测定
将10 μL试样溶液注入高效液相色谱仪,以保留时间定性,同时记录峰面积,根据标准曲线得到待测液中绞股蓝皂苷XL IX的浓度(试样溶液液相色谱图见附录A中图A.2)。
6 分析结果的表述
试样绞股蓝皂苷XL IX含量按式(1)计算:

式中:
X ——试样中绞股蓝皂苷XL IX的含量,单位为克每百克(g/100g)或克每百升(g/100mL);
ρ —— 样液中绞股蓝皂苷XL IX的浓度,单位为 mg/mL;
V—— 稀释体积,单位为毫升(mL);
m——试样的质量或体积,单位为克( g )或毫升( mL );
100—单位转换;
1000—单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10% 。
8 其他
当称样量为0.5 g或0.5 mL,定容体积为10 mL时,绞股蓝皂苷XL IX的检出限为0.005 g/100 g或0.005 g /100 mL,定量限为0.010 g/100 g或0.010 g /100 mL。
附录 A
标准溶液和试样溶液液相色谱图
A.1 绞股蓝皂苷XL IX标准溶液色谱图,见图 A.1。

图 A.1 绞股蓝皂苷XL IX标准溶液色谱图
A.2 含有绞股蓝皂苷XL IX的试样溶液色谱图,见图 A.2。

图 A.2 含有绞股蓝皂苷XL IX的试样溶液色谱图
二十二、保健食品中氨基葡萄糖的测定
Determination of Glucosamine in health food
1 范围
本方法规定了以氨基葡萄糖为功效成分的硬胶囊、软胶囊和片剂包装的保健食品中氨基葡萄糖的测定方法。
本方法适用于保健食品中氨基葡萄糖的含量测定。
本方法第一法紫外分光光度法的检出限为1.5μg。第二法高效液相色谱-紫外检测法的检出浓度为4μg /mL。
第一法 紫外分光光度法
2 原理
样品中D-氨基葡萄糖盐酸盐用水溶解,与乙酰丙酮、对二甲氨基苯甲醛试液显色之后,以试剂空白溶液为参比,以D-盐酸氨基葡萄糖为对照品,在525 nm波长处比色测定。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1乙酰丙酮(C5H8O2)。
3.1.2无醛乙醇(C2H5OH)。
3.1.3碳酸钠(NaCO3)。
3.1.4对二甲氨基苯甲醛(C9H11NO)。
3.1.5盐酸(HCl)。
3.1.6石油醚:沸程 30°C~60°C。
3.2 试剂配制
3.2.1 乙酰丙酮试液:取乙酰丙酮2 mL,加0.5 mol/L碳酸钠溶液至50 mL,临用前配制。
3.2.2 对二甲氨基苯甲醛试液:对二甲氨基苯甲醛0.8 g,加无醛乙醇15 mL及盐酸15 mL,摇匀,临用前配制。
3.3 标准品
D-盐酸氨基葡萄糖:纯度≥99.0%。
3.4 标准溶液的配制
3.4.1 盐酸氨基葡萄糖标准储备液(1.0 mg/mL):精确称量105℃干燥4小时至恒重的盐酸氨基葡萄糖对照品10mg,置于10mL容量瓶中,用水定容至刻度,摇匀,备用。
3.4.2盐酸氨基葡萄糖标准溶液(0.1 mg/mL):精密量取1.0 ml标准储备液,用水定容至10ml,作为标准溶液。
4 仪器设备
4.1 紫外分光光度计:波长525±2nm。
4.2 天平:感量为0.1 mg。
4.3 干燥箱。
4.4 恒温水浴锅。
4.5 离心机:转速 ≥3000 r/min。
4.6 超声波清洗器。
5 分析步骤
5.1 试样制备
5.1.1片剂、硬胶囊试样
称取已粉碎混合均匀的待测试样(硬胶囊称取混合均匀的内容物)约0.1~0.5g(精确到 0.0001 g),置100mL量瓶中,加水用超声波使其溶解,加水稀释至刻度,摇匀,滤过;精密量取续滤液适量,置50mL量瓶中,加水稀释至刻度,摇匀,即得供试品溶液。
5.1.2 软胶囊制品
称取混合均匀的油类制品 0.1 g~0.5g (精确到 0.0001 g) 至50 mL离心管中,加入50mL石油醚,轻摇溶解,3000 r/min 离心10 min后,弃去上层溶液,并用氮气吹干,用水将试样全部转移至100mL量瓶中,并用水分次洗涤,合并溶液至量瓶中,超声波使其溶解,用水稀释至刻度,摇匀,滤过;精密量取续滤液适量,置50mL量瓶中,加水稀释至刻度,摇匀,即得供试品溶液。
5.2 标准曲线的制作
吸取盐酸氨基葡萄糖标准溶液0、0.2、0.4 、0.6、0.8、1.0、1.2mL对照品溶液,置25mL具塞比色管中,加水至5mL。分别加乙酰丙酮试液(取乙酰丙酮2 mL,加0.5 mol/L碳酸钠溶液至50 mL,临用前配制)1 mL,摇匀,置沸水浴中加热25分钟,取出,用冰水迅速冷却后,加无醛乙醇3.0 mL,60℃水浴中保温10分钟,再加对二甲氨基苯甲醛试液1.0 mL,强烈振摇,继续在60℃水浴中保温1小时,冷却至室温。用分光光度计在525 nm波长处以试剂空白溶液为参比,1cm比色皿测定吸光度值。以D-盐酸氨基葡萄糖质量(μg)为横坐标,吸光度值为纵坐标,绘制标准曲线。
5.3 试样溶液的测定
精密吸取供试品溶液5.0mL,分别置25mL具塞比色管中,加乙酰丙酮试液1 mL,以下按“标准曲线”进行操作,测定供试品溶液吸光度值,从标准曲线査得氨基葡萄糖含量,计算,即得。
6 分析结果的表述
试样中氨基葡萄糖(以盐酸氨基葡萄糖计)含量按式(1)计算:
Ci ×V×F×100
Xi = ..........................................(1)
m×V0×1000000
式中:
Xi——试样中氨基葡萄糖的含量,单位为克每百克(g/100g);
Ci——由标准曲线查得测定样液中氨基葡萄糖的含量,单位为微克(μg);
V——被测定样液的定容体积,单位为毫升( mL);
F——被测定样液的稀释倍数;
V0——样品被测定时的取样体积,单位为毫升( mL);
m——试样的称样质量,单位为克( g);
100——单位转换;
1000000——单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
第二法 高效液相色谱-紫外检测法
8 原理
试样中的氨基葡萄糖经溶解、稀释、过滤后,使用具有紫外检测器的高效液相色谱仪检测,根据色谱峰的保留时间定性,外标法定量。
9 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
9.1 试剂
9.1.1戊烷磺酸钠(纯度≥99.5%)。
9.1.2乙腈(色谱纯)。
9.1.3石油醚:沸程 30°C~60°C。
9.2 试剂配制
戊烷磺酸钠溶液:称取3.48g戊烷磺酸钠(纯度≥99.5%)用2000mL水溶解,浓度为10mmol/L。
9.3 标准品
D-盐酸氨基葡萄糖:纯度≥99.0%。
9.4 标准溶液的配制
9.4.1 盐酸氨基葡萄糖标准储备液(1.0 mg/mL):精确称量105℃干燥4小时至恒重的盐酸氨基葡萄糖对照品10mg,置于10mL容量瓶中,用水定容至刻度,摇匀,备用。
9.4.2盐酸氨基葡萄糖标准溶液:吸取盐酸氨基葡萄糖标准储备液0.5、1.0、1.5、2.0、4.0mL,置10mL量瓶中,用流动相定容至10ml,作为标准溶液。
10 仪器设备
10.1 高效液相色谱仪:附紫外检测器或DAD检测器。
10.2 天平:感量为0.1 mg。
10.3 干燥箱。
10.4 超声波清洗器。
10.5 离心机:转速 ≥3000 r/min。
11 分析步骤
11.1 试样制备
11.1.1 试样处理
见5.1.1。精密量取续滤液适量,置50mL量瓶中,加流动相稀释至刻度后,摇匀,经0.45μm滤膜过滤后即得供试品溶液。
11.2 色谱参考条件
11.2.1 色谱柱:Cl8 4.6mm×250mm不锈钢柱。
11.2.2 柱温:35℃。
11.2.3 检测波长:192nm。
11.2.4 流动相:乙腈+戊烷磺酸钠溶液=10+90。
11.2.5 流速:0.8mL/min。
11.2.6 进样量:10μL。
11.3 标准曲线的制作
将10 μL的标准系列各浓度溶液(9.4.2),注入液相色谱仪中,测得相应的峰面积,以标准溶液浓度为横坐标,以峰面积为纵坐标,绘制标准曲线 (标准溶液液相色谱图见附录 A 中图 A.1 )。
11.4 试样溶液的测定
将10 μL的试样待测液(11.1.1)注入液相色谱仪中,以保留时间定性,测得峰面积,根据标准曲线得到待测液盐酸氨基葡萄糖的浓度(样品溶液液相色谱图见附录A中图A.2)。
12 分析结果的表述
试样中氨基葡萄糖(以盐酸氨基葡萄糖计)含量按式(2)计算:
Ci ×V×F×100
Xi = ..........................................(2)
m×1000000
式中:
Xi——试样中氨基葡萄糖的含量,单位为克每百克(g/100g);
Ci——由标准曲线查得测定样液中盐酸氨基葡萄糖的含量,单位为微克(μg/mL);
V——被测定样液的定容体积,单位为毫升( mL);
F——被测定样液的稀释倍数;
m——试样的称样质量,单位为克( g);
100——单位转换;
1000000——单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
13 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
附录 A
标准溶液和试样溶液典型液相色谱图
A.1 盐酸氨基葡萄糖标准溶液色谱图,见图 A.1。

图 A.1 盐酸氨基葡萄糖标准溶液色谱图
A.2 含有氨基葡萄糖的试样溶液色谱图,见图 A.2。

图 A.2 含有氨基葡萄糖的试样溶液色谱图
二十三、保健食品中总三萜的测定
Determination of total triterpenes in health food
1 范围
本方法规定了保健食品中总三萜的紫外-可见分光光度测定方法。
本方法适用于以三萜类成分为主要原料的保健食品中总三萜含量的测定。
2 原理
试样用氯仿提取出的三萜类物质,在高氯酸的作用下与香草醛反应产生有色物质。以熊果酸为对照品,采用分光光度法测定总三萜在548nm波长下的吸光度进行定量。
3 试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
试剂
3.1.1 乙酸乙酯( CH3COOCH2CH3)。
3.1.2 氯仿(CHCl3)。
3.1.3 冰乙酸(CH3COOH)。
3.1.4 高氯酸(HClO4)
3.1.5 香草醛(C8H8O3)
试剂配制
5%香草醛冰乙酸溶液:此溶液临用前配制。精密称取香草醛 0.5g,加冰乙酸使溶解成 10mL,即得。
标准品
熊果酸(C30H48O3):中国食品药品检定研究院,含量:≥93.8%。
标准溶液的配制
熊果酸对照品溶液(100μg/mL):精密称取熊果酸对照品10mg,至100mL容量瓶中,加乙酸乙酯溶解并稀释至刻度,摇匀。
4 仪器设备
4.1 紫外-可见分光光度计。
4.2 分析天平:精确至0.1 mg。
4.3 恒温水浴锅。
4.4 超声波清洗器
4.5 离心机
5 分析步骤
5.1试样制备
5.1.1 固体试样
取一定量混匀试样,精密称定(试样中总三萜的量约为0.5~5mg),置50mL量瓶中,加氯仿约30mL,超声处理30 min,放冷,加氯仿至刻度,摇匀。
5.1.2 油类制品
准确称取混匀试样适量(试样中总三萜的量约为0.5~5mg),置于100 mL容量瓶中,用乙酸乙酯溶解并稀释至刻度,摇匀。
5.2 标准曲线的制作
分别精密吸取熊果酸对照品溶液0.1、0.2、0.4、0.8、1.0mL于蒸发皿中,于60℃水浴上蒸干,精密加入0.4mL5%香草醛冰乙酸溶液,转动蒸发皿使残渣溶解,再精密加1.0mL高氯酸,混匀后移入10mL具塞比色管中,置60℃水浴加热15min,取出,冰浴冷却后,精密加入冰乙酸5.0mL摇匀,15min后以1cm比色池于548nm波长测定吸光度, 以吸光度为纵坐标、浓度为横坐标绘制标准曲线。
5.3 试验溶液的测定
精密量取5.1项下试样上清液1.0mL置蒸发皿中,于60℃水浴上蒸干。照5.2标准曲线的制作项下,自“精密加入0.4mL5%香草醛冰乙酸溶液……”起,同法操作,测定吸光度,从标准曲线上读出供试品溶液中熊果酸的含量。
6 分析结果的表述
试样中总三萜含量按下式计算:
Xi= 

Xi-试样中总三萜含量(以熊果酸计),单位为克每百克(g/100g);
Ci-由标准曲线查得测定样液中总三萜质量,单位为微克(μg);
m-试样的称样质量,单位为克(g);
V1-试样定容总体积,单位为毫升(mL);
V2-测定用试样体积,单位为毫升(mL)。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
本方法定量限为1.5μg
二十四、保健食品中虫草素的测定
Determination of Content of Cordycepin in health food
1 范围
本方法规定了保健食品中虫草素的液相色谱测定方法。
本方法适用于保健品食品中虫草素的测定。
2 原理
试样经酸水溶解,加偏磷酸溶液沉淀干扰物质,反相色谱分离,与标准品的保留时间比较定性,以峰面积外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 偏磷酸(HPO3):分析纯。
3.1.2 甲醇(CH3OH):色谱纯。
3.2 试剂配制
偏磷酸溶液(30.0g/L):称取30.0g偏磷酸,于装有约600mL水的三角瓶中,在磁力搅拌器搅拌上溶解,转移至1000mL容量瓶中,用水定容至1000mL,混匀。
3.3 标准品
虫草素(C10H13N5O3):纯度≥98.0%。
3.4 标准溶液的配制
3.4.1虫草素标准储备溶液(0.5 mg/mL):称取标准品25mg于50mL容量瓶中,用水溶解并定容至刻度 ,摇匀。此溶液应贮存于-18°C 冰箱中。
3.4.2 虫草素标准工作液:吸取虫草素标准储备溶液0.10mL、0.20mL、0.5mL、1.0mL、2.0mL、5.0 mL 于 50.0 mL 容量瓶中,用水定容,得浓度为 1 mg/mL、2mg/mL、5mg/mL、10 mg/mL、20 mg/mL、50 mg/mL 的标准工作液,临用时配制。
4 仪器设备
4.1 高效液相色谱仪: 附紫外检测器(UV)。
4.2 天平:感量为 1 mg 和 0.1 mg。
4.3 超声波清洗器。
4.4 离心机:转速 ≥4000 r/min。
4.5 磁力搅拌器。
5 分析步骤
5.1 试样制备
5.1.1 试样处理
5.1.1.1 固体样品:取20粒以上片剂或胶囊试样进行粉碎、混匀,或取半固态试样混匀(软胶囊称取内容物),准确称取均匀试样1g(可根据样品中含量而定,精确至0.001g),置50mL容量瓶中,加水30mL,混匀,超声震荡30min,加入30.0g/L偏磷酸溶液(3.2)1.0mL,轻轻振荡,加水稀释至刻度,摇匀。样品经0.45μm 滤膜过滤后进液相色谱分析。
5.1.1.2 液体样品:准确吸取一定量摇匀后的试样10 mL(可根据试样含量而定)于50 mL容量瓶中,加水20mL,混匀,超声震荡30min,加入30.0g/L偏磷酸溶液(3.2)1.0mL,轻轻振荡,加水稀释至刻度,摇匀。样品经0.45μm 滤膜过滤后进液相色谱分析。
5.2色谱参考条件
5.2.1 色谱柱:C18柱,4.6×250 mm, 5 μm或同等性能色谱柱。
5.2.2 柱温:30 ℃
5.2.3 检测波长:260 nm
5.2.4 流动相:甲醇-水=15:85
5.2.5 流速:1.0 mL/min
5.2.6 进样量:10 mL
5.3 标准曲线的制作
将10 μL的标准系列各浓度溶液(3.4.2) ,注入液相色谱仪中,测得相应的峰面积或峰高, 以标准工作液的浓度为横坐标,以峰面积或峰高为纵坐标,绘制标准曲线 (标准溶液液相色谱图见附录 A 中图 A.1 )。
5.4 试验溶液的测定
将 10 μL 的试样待测液(5.1.1)注入液相色谱仪中,以保留时间定性,测得峰面积或峰高,根据标准曲线得到待测液虫草素的浓度(样品溶液液相色谱图见附录A中图A.2)。
6 分析结果的表述
试样中虫草素含量按式(1)计算:
Ci ×V×100
Xi = ..........................................(1)
m×1000000
式中:
Xi——试样中虫草素的含量,单位为克每百克或克每百毫升(g/100g/g/100mL);
Ci——由标准曲线查得测定样液中虫草素的浓度,单位为微克每毫升(mg/mL);
V——被测定样液的最终定容体积,单位为毫升( mL);
m——测定用试样的量,单位为克或毫升( g或mL);
100——单位转换;
1000000——单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留两位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
8 其他
当称样量为1 g,定容体积为 50 mL时,虫草素定量限为0.0010 g/100g。
附录 A
标准溶液和试样溶液典型液相色谱图
A.1 虫草素标准溶液色谱图,见图 A.1。 

图 A.1 虫草素标准溶液色谱图
A.2 含有虫草素的试样溶液色谱图,见图 A.2。

图 A.2 含有虫草素的试样溶液色谱图
二十五、保健食品中虫草酸的测定
Determination of mannitol in health food
1 范围
本方法规定了保健食品中虫草酸(甘露醇)的高效液相色谱法测定方法。
本方法适用于保健食品中虫草酸(甘露醇)含量的测定。
2 原理
试样中的虫草酸经提取后在氨基色谱柱上分离,用蒸发光散射检测器检测,根据保留时间定性,标准曲线法定量检测。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 乙腈(C2H3N):色谱纯。
3.1.2 无水乙醇(C2H5OH)。
3.2 试剂配制
提取液:取40mL水与60mL无水乙醇(3.1.2)混合,即得。
标准品
虫草酸(D-甘露醇)对照品:纯度≥99%。
标准溶液的配制
虫草酸标准溶液(10.0mg/mL): 准确称量虫草酸标准品0.250 g,加入水溶解后,用水定容至25 mL,即得虫草酸标准溶液
标准系列溶液制备:精密吸取虫草酸标准溶液0.1mL、0.2mL、0.5mL、1.0mL、2.0mL、4.0mL分别置于10mL容量瓶中,用水定容至刻度,摇匀。临用时配制。
4 仪器
4.1 高效液相色谱仪: 附蒸发光散射检测器(ELSD)。
4.2 超声波清洗器。
4.3 离心机:转速≥4000r/min。
4.4 分析天平:感量0.01 mg,0.1 mg
5 分析步骤
5.1 试样处理
5.1.1 固体样品:取20粒以上片剂或胶囊试样进行粉碎、混匀,或取半固态试样混匀(软胶囊称取内容物),准确称取均匀试样0.5 g(可根据样品中含量而定,精确至0.001g),置圆底烧瓶中,加入25mL提取液(3.2),混匀,称重,水浴回流60min,取出,冷却后称重,补足减失的重量,摇匀,经0.45μm微孔滤膜过滤,滤液待分析。
5.1.2 液体样品:准确吸取一定量摇匀后的试样10 mL(可根据试样含量而定)于25 mL容量瓶中,加入无水乙醇(3.1.2)10mL,混匀,超声振荡30min,取出,冷却,定容至刻度。混匀后经0.45 μm滤膜过滤,供液相色谱分析用。
5.2 色谱参考条件
5.2.1 色谱柱:氨基液相色谱柱,4.6×250 mm, 5 μm或同等性能色谱柱。
5.2.2 流动相:流动相A为水,流动相B为乙腈。水-乙腈=25:75。
5.2.3 柱温:30℃。
5.2.4 流速:1.0 mL/min。
5.2.5 进样量:10 mL。
5.2.6 蒸发光散射检测器:气体流速:1.60slm,漂移管温度:60℃, 增益:1 。
5.3 标准曲线制备
分别配制一系列虫草酸标准溶液,在给定的仪器条件下进行液相色谱分析,以虫草酸的浓度(C)的对数LogC为横坐标,相应的色谱峰面积(A)的对数LogA为纵坐标,绘制标准曲线。
6 测定
取10 μL标准溶液及试样溶液注入色谱仪中,以保留时间定性,以试样峰面积与标准系列比较定量。
7 结果计算
试样中虫草酸含量按式(1)计算:
Xi = ..........................................(1)
..........................................(1)
式中:
Xi——试样中虫草酸的含量,单位为克每百克或克每百毫升(g/100g或g/100mL);
Ci——由标准曲线查得测定样液中虫草酸的浓度,单位为毫克每毫升( mg/mL);
V——被测定样液的定容体积,单位为毫升( mL);
m——试样的称样质量,单位为克或毫升( g或mL);
100——单位转换;
1000——单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留两位有效数字。
8 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10% 。
9 其他
本方法检出限为0.1μg;
蒸发光散射检测器的响应值(y)与被测物浓度(x)的关系曲线由于仪器品牌和结构的不同,大多可能是指数关系,即y=axb,也可根据实际情况选择合适的关系曲线。
附录 A
标准溶液和试样溶液典型色谱图
A.1 虫草酸标准溶液色谱图,见图 A.1。

图A.1 虫草酸标准溶液色谱图
A.2 含有虫草酸的试样溶液色谱图,见图 A.2。

图A.2 含有虫草酸的试样溶液色谱图
第三部分
十一种溶剂残留的测定
Determination of 11 kinds of
Residual Organic Solvents
1 范围
本标准规定了保健食品中甲醇、正丁醇、异丁醇、氯仿、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯11种溶剂残留的气相色谱测定方法。
本标准适用于保健食品中甲醇、正丁醇、异丁醇、氯仿、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯11种溶剂残留的测定。
2 原理
样品经50% N,N-二甲基甲酰胺溶液提取后,采用顶空-气相色谱法测定,用外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.5 试剂
N,N-二甲基甲酰胺(HCON(CH3)2):色谱纯
3.6 试剂配置
50%的N,N-二甲基甲酰胺溶液: 500 mL N,N-二甲基甲酰胺与500 mL水充分互溶混合。
3.7 标准品
甲醇(CH4O)、正丁醇(CH3(CH2)3OH)、异丁醇(CH3CH(CH3)CH2OH)、氯仿(CHCl3)、正己烷(C6H14)、甲苯(C7H8)、对二甲苯(C8H10)、邻二甲苯(C8H10)、苯乙烯(C8H8)、1,2-二乙基苯(C10H14)和二乙烯苯(C10H10)标准品:纯度≥97.0%。
3.8 标准溶液的配制
3.4.1 标准储备液:分别准确称取2500 mg(精确至0.1 mg) 甲醇,1200 mg(精确至0.1 mg)正丁醇、异丁醇、氯仿、120 mg(精确至0.1 mg)正己烷和二乙烯苯,100 mg(精确至0.1 mg)甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯于100 mL容量瓶中,用N,N-二甲基甲酰胺定容至刻度 ,摇匀。得甲醇浓度为25 mg/mL、正丁醇、异丁醇、氯仿浓度为12 mg/mL,正己烷和二乙烯苯浓度为1.2 mg/mL,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度为1mg/mL标准储备液,4°C保存。
3.4.2混合标准中间液:分别准确吸取2.0 mL甲醇标准储备液;1.0 mL 正丁醇、异丁醇、氯仿、正己烷、二乙烯苯、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯、标准储备液于同一100 mL 容量瓶中,用50%的N,N-二甲基甲酰胺溶液定容至刻度 ,摇匀。该混合标准中间液中甲醇浓度为500 μg/mL,正丁醇、异丁醇、氯仿浓度为120 μg/mL,正己烷、二乙烯苯浓度为12.0 μg/mL,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度为10.0 μg/mL。该中间液放置4°C保存。
3.4.3 混合标准工作液:准确吸取混合标准中间液0.05 mL、0.20 mL、0.50 mL、1.0 mL、2.0 mL、5.0 mL于10.0 mL 容量瓶中,用50% N,N-二甲基甲酰胺定容,得甲醇浓度为2.50 μg /mL 、10.0 μg /mL、25.0 μg /mL、50.0 μg /mL、100 μg /mL、250 μg /mL,正丁醇、异丁醇、氯仿浓度为0.60 μg /mL 、2.40 μg /mL、6.00 μg /mL、12.0 μg /mL、24.0 μg /mL、60.0 μg /mL,正己烷、二乙烯苯浓度为0.06 μg /mL 、0.24μg /mL、0.60 μg /mL、1.20 μg /mL、2.40 μg /mL、6.00 μg /mL;甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度为0.05 μg /mL 、0.20 μg /mL、0.50 μg /mL、1.00 μg /mL、2.00 μg /mL、5.00 μg /mL的标准工作液,临用时配制。
4 仪器设备
4.1 气相色谱仪:配有氢火焰离子化检测器( FID)。
4.2 顶空自动进样器。
4.3 顶空瓶:20 mL,配备铝盖和不含烃类溶剂残留的丁基橡胶或硅树脂胶隔垫。
4.4 天平:感量为 1 mg 和 0.1 mg。
4.5 离心机:转速 ≥4000 r/min。
4.6 超声波清洗器。
5 分析步骤
5.1 试样制备
5.1.1 固体基质
称取样品0.5 g (精确到0.001 g) 于20 mL顶空瓶中,加入5 mL50% N,N-二甲基甲酰胺溶液,摇匀后密封,超声处理10 min,即得。
5.1.2 液体基质
称取样品1.0 g至2.0 g (精确到0.001 g) 于10 mL容量瓶中,加入50% N,N-二甲基甲酰胺溶液定容至刻度,摇匀,准确吸取5 mL溶液至20mL顶空瓶中,密封,即得。
5.2仪器参考条件
5.2.1顶空进样参考条件
a) 平衡时间:30 min。
b) 平衡温度:90 °C。
c) 进样体积:1.0 mL。
5.2.2色谱参考条件
a) 色谱柱:以键合/交联聚乙二醇为固定相的毛细管柱,柱长为30 m,内径为0.32 mm,膜厚度为0.50 μm或性能相当者。
b) 柱温箱温度:起始温度40 °C,保持5 min ,10 °C/min 升温至 150 °C,保持1 min,再以20 °C/min升至200 °C,保持2 min。
c) 进样口温度:200 °C。
d) 分流比:15∶1
e) FID 检测器温度:250°C。
f) 载气:高纯氮气,流量 1.5 mL/min,尾吹 30 mL/min。
g) 氢气流量:40 mL/min。
h) 空气流量:300 mL/min。
5.3 标准曲线的制作
准确吸取3.4.2中各浓度的标准工作溶液5 mL置于顶空瓶中,进行气相色谱测定,测得相应的峰面积, 以标准工作液中相应溶剂的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线 (标准溶液气相色谱图见附录 A 中图 A.1 )。
5.4 试验溶液的测定
将5.1中试样待测液进行气相色谱仪测定,以保留时间定性,测得峰面积,根据标准曲线计算试样中各溶剂残留的含量。
6 分析结果的表述
试样中各溶剂残留含量按式(1)计算:
式中:
X——试样中各溶剂残留的含量,单位为毫克每千克(mg/kg);
C——由标准曲线查得测定样液中各溶剂残留的浓度,单位为微克每毫升(μg/mL);
m——试样的称样质量,单位为克( g);
V——顶空瓶中供试样溶液的体积,单位为毫升(mL);
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 15 % 。
8 其他
当称样量为0.5 g 时,甲醇的检出限为4 mg/kg,定量限为10 mg/kg,正丁醇、异丁醇、氯仿检出限为2 mg/kg,定量限为6 mg/kg,正己烷、二乙烯苯的检出限为0.2 mg/kg,定量限为0.6 mg/kg,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯、二乙烯苯检出限为0.08 mg/kg,定量限为0.30 mg/kg。
附录 A
11种溶剂标准物质的典型气相色谱图
11种溶剂的标准物质的气相色谱图见图A.1

图A.1 11种溶剂标准物质的气相色谱图
1:正己烷 2:甲醇 3:氯仿 4:甲苯 5:异丁醇 6:对二甲苯 7:正丁醇 8:邻二甲苯 9:苯乙烯 10:二乙基苯 11:二乙烯苯
第四部分
兴奋剂及违禁成分测定
Determination of Stimulant and
Prohibited Components
兴奋剂及违禁成分测定
|
产品功能
|
兴奋剂、违禁成分
|
检验方法编号
|
|
缓解体力疲劳、
增强免疫力
|
2-羟丙基去甲他达拉非 ; 2-羟乙基去甲他达拉非 ; N-苯丙烯基他达拉非 ; N-丁基他达拉非 ; N-去甲基西地那非 ; N-去乙基-N-甲基伐地那非 ; N-去乙基伐地那非 ; N-去乙基红地那非 ; N-叔丁氧羰基-N-去乙基红地那非 ; N-辛基去甲他达拉非 ; N-乙基他达拉非 ; O-去乙基西地那非 ; 阿伐那非 ; 艾地那非 ; 氨基他达拉非 ; 氨基西地那非 ; 苯噻啶红地那非 ; 苯酰胺那非 ; 吡唑N-去甲基西地那非 ; 苄西地那非 ; 丙氧苯基艾地那非 ; 丙氧苯基硫代艾地那非 ; 丙氧苯基硫代豪莫西地那非 ; 丙氧苯基硫代羟基豪莫西地那非 ; 丙氧苯基硫代西地那非 ; 丙氧苯基羟基豪莫西地那非 ; 丙氧苯基西地那非 ; 丙氧苯基异丁基艾地那非 ; 达泊西汀 ; 二甲基红地那非 ; 二硫代去甲基卡巴地那非 ; 二硫代去乙基卡巴地那非 ; 伐地那非 ; 伐地那非N-氧化物 ; 伐地那非二聚体 ; 伐地那非哌嗪酮 ; 伐地那非乙酰基类似物 ; 桂地那非 ; 豪莫西地那非 ; 红地那非 ; 环戊那非 ; 卡巴地那非 ; 硫代艾地那非 ; 硫代豪莫西地那非 ; 硫代西地那非 ; 硫喹哌非 ; 罗地那非碳酸酯 ; 氯地那非 ; 米罗那非 ; 那非乙酰酸 ; 那红地那非 ; 那莫伐地那非 ; 那莫西地那非 ; 哌唑那非 ; 羟基伐地那非 ; 羟基豪莫西地那非 ; 羟基红地那非 ; 羟基硫代伐地那非 ; 羟基硫代豪莫西地那非 ; 羟基硫代红地那非 ; 羟基氯地那非 ; 庆地那非 ; 去甲基卡巴地那非 ; 去甲基硫代西地那非 ; 去甲基哌嗪基西地那非磺酸 ; 去甲基他达拉非 ; 去碳西地那非 ; 去乙基卡巴地那非 ; 双氯地那非 ; 双去碳西地那非 ; 双酮红地那非 ; 他达拉非 ; 他达拉非二氯代杂质 ; 他达拉非甲基氯化物 ; 酮红地那非 ; 脱硫伐地那非 ; 脱哌嗪基硫代西地那非 ; 伪伐地那非 ; 乌地那非 ; 西地那非 ; 西地那非N-氧化物 ; 西地那非二聚体杂质 ; 西地那非杂质12 ; 西地那非杂质14 ; 硝地那非 ; 亚硝地那非 ; 乙酰胺基他达拉非 ; 乙酰伐地那非 ; 异丁基西地那非 ; 育亨宾
|
食品中那非类物质的测定(BJS 201805);
补肾壮阳类中成药中西地那非及其类似物的检测方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2008016);
补肾壮阳类中成药中PDE5型抑制剂的快速检测方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2009030)。
|
|
减肥
|
N,N-双去甲基西布曲明 ; N-单去甲基西布曲明 ; 安非他明 ; 安非他酮 ; 奥利司他 ; 苯丙醇胺 ; 苯扎贝特 ; 比沙可啶 ; 苄基西布曲明 ; 布美他尼 ; 非诺贝特 ; 分特拉明 ; 芬氟拉明 ; 酚酞 ; 呋塞米 ; 氟西汀 ; 豪莫西布曲明 ; 甲基安非他明 ; 甲基麻黄碱 ; 咖啡因 ; 利莫那班 ; 洛伐他汀 ; 氯代西布曲明 ; 氯卡色林 ; 氯噻嗪 ; 麻黄碱 ; 普伐他汀 ; 氢氯噻嗪 ; 去甲伪麻黄碱 ; 伪麻黄碱 ; 西布曲明 ; 辛伐他汀 ; 吲达帕胺
|
食品中西布曲明等化合物的测定(BJS 201701);
治疗肥胖症的中成药中西布曲明、麻黄碱、芬氟拉明的检测方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2006004);
减肥类保健食品违法添加药物的检测方法(食药监办许(2010)114号);
减肥类中成药或保健食品中酚酞、西布曲明及两种衍生物的检测方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2012005)。
|
|
辅助降血糖、
辅助降血脂、
辅助降血压、
改善睡眠
|
阿普唑仑 ; 阿替洛尔 ; 艾司唑仑 ; 氨甲环酸 ; 氨氯地平 ; 奥沙西泮 ; 巴比妥 ; 苯巴比妥 ; 苯乙双胍 ; 吡咯列酮 ; 醋氯芬酸 ; 地西泮 ; 丁二胍 ; 二甲双胍 ; 二氧丙嗪 ; 非洛地平 ; 格列苯脲 ; 格列吡嗪 ; 格列波脲 ; 格列喹酮 ; 格列美脲 ; 格列齐特 ; 甲苯磺丁脲 ; 卡托普利 ; 可乐定 ; 劳拉西泮 ; 利血平 ; 罗格列酮 ; 罗通定 ; 洛伐他汀羟酸钠盐 ; 氯苯那敏 ; 氯氮卓 ; 氯美扎酮 ; 氯硝西泮 ; 美伐他汀 ; 咪达唑仑 ; 尼莫地平 ; 尼群地平 ; 尼索地平 ; 哌唑嗪 ; 青藤碱 ; 瑞格列奈 ; 三唑仑 ; 沙丁胺醇 ; 司可巴比妥 ; 褪黑素 ; 脱羟基洛伐他汀 ; 文拉法辛 ; 硝苯地平 ; 硝西泮 ; 烟酸 ; 异戊巴比妥 ; 扎来普隆 ; 佐匹克隆
|
保健食品中75种非法添加化学药物的检测(BJS 201710);
降糖类中成药中非法添加化学药品补充检验方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2009029);
降糖类中成药中非法添加盐酸丁二胍补充检验方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2011008);
降糖类中成药和辅助降血糖类保健食品中非法添加格列波脲的补充检验方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2013001);
辅助降血脂类保健食品违法添加药物的检测方法(食药监办许(2010)114号);
保健食品中非法添加沙丁胺醇检验方法等8项检验方法(食药监食监三[2016]28号);
降压类中成药中非法添加化学药品补充检验方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2009032);
降压类中成药和辅助降压类保健食品中非法添加六种二氢吡啶类化学成分检测方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2014008);
安神类中成药中非法添加化学品检测方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2009024);
安神类中成药和保健食品中非法添加褪黑素、佐匹克隆、氯苯那敏、扎来普隆的补充检验方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2012004);
改善睡眠类中成药及保健品中非法添加罗通定、青藤碱、文拉法辛补充检验方法(国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2013002)。
|
第五部分
不同剂型及特定原料类别产品的
卫生学检测项目
Hygienic Testing Items for Products with Different Dosage Forms and Specific RawMaterials
不同剂型及特定原料类别产品的卫生学检测项目
|
|
产品类型
|
检测项目
|
|
1
|
固体
|
水分、灰分
|
|
2
|
口服液
|
可溶性固形物、pH值、防腐剂
|
|
3
|
片剂和胶囊剂
|
崩解时限
|
|
4
|
茶剂
|
水分、有机氯农药残留(六六六、滴滴涕)
|
|
5
|
丸剂
|
融散时限
|
|
6
|
含片
|
溶化性
|
|
7
|
颗粒剂
|
溶化性、粒度
|
|
8
|
酒剂
|
总固体、酒精度、甲醇、氰化物(蒸馏酒)
|
|
9
|
鱼油类软胶囊
|
酸价、过氧化值(降血脂类产品需检测胆固醇)
|
|
10
|
中药材
|
六六六、滴滴涕以及药典规定相关其他农药、重金属及有害元素
|
|
11
|
苹果、山楂
|
展青霉素
|
|
12
|
乳产品
|
黄曲霉毒素M1、M2、防腐剂
|
|
13
|
蜂蜜、蜂胶类产品
|
抗生素
|
|
14
|
海产品
|
镉、砷、汞
|
|
15
|
红曲
|
黄曲霉毒素B1、B2、G1、G2、桔青霉素
|
|
16
|
植物油
|
黄曲霉毒素B1、酸价、过氧化值
|
第六部分
特定原料类别产品的功效成分和
标志性成分检测项目
Testing Items for Functional and Iconic Components of Products with Specific RawMaterial
特定原料类别产品的功效成分和标志性成分检测项目
|
|
原料类别
|
检测项目
|
|
1
|
营养素补充剂
|
产品中标识的营养素(包括维生素和矿物质)
|
|
2
|
五加科参类
|
皂苷
|
|
3
|
蕈类(蘑菇等)
|
膳食纤维、多糖、总三萜(灵芝类)
|
|
4
|
虫草类
|
腺苷
|
|
5
|
红景天类
|
红景天苷
|
|
6
|
芦荟类
|
芦荟苷
|
|
7
|
大蒜类
|
大蒜素
|
|
8
|
螺旋藻类
|
蛋白质、胡萝卜素、维生素B1、维生素B2
|
|
9
|
茶叶类
|
茶多酚
|
|
10
|
魔芋类
|
膳食纤维
|
|
11
|
纤维素类
|
膳食纤维
|
|
12
|
磷脂类
|
丙酮不溶物、乙醇可溶物、正己烷不溶物(卵磷脂原料)等
|
|
13
|
红曲类
|
洛伐他汀
|
|
14
|
植物油类
|
脂肪酸、维生素E
|
|
15
|
动物油类
|
脂肪酸
|
|
16
|
初乳类
|
免疫球蛋白
|
|
17
|
鹿血类
|
蛋白质、氨基酸
|
|
18
|
蚂蚁类
|
锰、蛋白质
|
|
19
|
蚯蚓类
|
蚓激酶(溶纤酶)、蛋白质
|
|
20
|
蛇、蝎等
|
蛋白质、氨基酸
|
|
21
|
角鲨烯
|
角鲨烯
|
|
22
|
蜂皇浆
|
10-羟基癸烯酸
|
|
23
|
蜂花粉、蜂胶
|
总黄酮
|
|
24
|
甲壳质产品
|
脱乙酰度,产品如为复方应检测原料的脱乙酰度
|
|
25
|
蛋白质、氨基酸制品
|
蛋白质、氨基酸
|
|
26
|
褪黑素产品
|
产品原料(褪黑素)需提供原料纯度证明并检测
|
|
27
|
辅酶Q10产品
|
产品原料(辅酶Q10)需提供制备工艺及纯度证明并检测
|
|
28
|
含蒽醌类成分的原料
|
总蒽醌
|
|
29
|
阿胶类
|
杂皮特征肽
|
附录
附录1 部分功效成分/标志性成分检测方法国家标准
|
序号
|
功效成分/标志性成分
|
标准号
|
|
1
|
α-亚麻酸、二十碳五烯酸、二十二碳五烯酸、二十二碳六烯酸
|
GB 28404 |
|
2
|
前花青素
|
GB/T 22244 |
|
3
|
异嗪皮啶
|
GB/T 22245 |
|
4
|
泛酸钙
|
GB/T 22246 |
|
5
|
淫羊藿苷
|
GB/T 22247 |
|
6
|
甘草酸
|
GB/T 22248 |
|
7
|
番茄红素
|
GB/T 22249 |
|
8
|
绿原酸
|
GB/T 22250 |
|
9
|
葛根素
|
GB/T 22251 |
|
10
|
辅酶Q10
|
GB/T 22252 |
|
11
|
大豆异黄酮
|
GB/T 23788 |
|
12
|
褪黑素
|
GB/T 5009.170 |
|
13
|
超氧化物歧化酶(SOD)
|
GB/T 5009.171 |
|
14
|
脱氢表雄甾酮
|
GB/T 5009.193 |
|
15
|
免疫球蛋白IgG
|
GB/T 5009.194 |
|
16
|
吡啶甲酸铬
|
GB/T 5009.195 |
|
17
|
肌醇
|
GB/T 5009.196 |
|
18
|
盐酸硫胺素、盐酸吡哆醇、烟酸、烟酰胺、咖啡因
|
GB/T 5009.197 |
|
19
|
维生素B12
|
GB/T 5009.217 |
|
20
|
维生素K1
|
GB 5009.158 |
|
21
|
维生素B6
|
GB 5009.154 |
|
22
|
维生素B2
|
GB 5009.85 |
|
23
|
维生素B1
|
GB 5009.84 |
|
24
|
维生素A、D、E
|
GB 5009.82 |
|
25
|
硼、钠、镁、铝、钾、钙、钛、钒、铬、锰、铁、钴、镍、铜、锌、砷、硒、锶、钼、镉、锡、锑、钡、汞、铊、铅、磷
|
GB 5009.268 |
|
26
|
大豆低聚糖
|
GB/T 22491 |
|
27
|
低聚异麦芽糖
|
GB/T 20881 |
|
28
|
低聚果糖
|
GB/T 23528 |
|
29
|
磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇
|
GB 5009.272 |
|
30
|
硫酸软骨素和盐酸氨基葡萄糖
|
GB/T 20365 |
附录2 常用卫生指标检测方法
| 序号 | 卫生指标 | 常用检测方法 | 序号 | 卫生指标 | 常用检测方法 |
| 1 | 铅 | GB 5009.12 | 11 | 水分 | GB 5009.3 |
| 2 | 砷 | GB 5009.11 | 12 | 灰分 | GB 5009.4 |
| 3 | 汞 | GB 5009.17 | 13 | 过氧化值 | GB 5009.227 |
| 4 | 镉 | GB 5009.15 | 14 | 酸价 | GB 5009.229 |
| 5 | 铬 |
GB 5009.123
《中华人民共和国药典》
|
15 | 崩解时限 | 《中华人民共和国药典》 |
| 6 | 六六六 | GB 5009.19 | 16 | 溶散时限 | 《中华人民共和国药典》 |
| 7 | 滴滴涕 | GB 5009.19 | 17 | pH值 | GB 5009.237 |
| 8 | 桔青霉素 | GB 5009.222 | 18 | 溶化性 | 《中华人民共和国药典》 |
| 9 | 黄曲霉毒素M1、M2 | GB 5009.24 | 19 | 粒度 | 《中华人民共和国药典》 |
| 10 | 黄曲霉毒素B1 | GB 5009.22 | 20 | 展青霉素 | GB 5009.185 |

【返回 】

